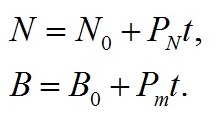|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VIII Сабининские чтения 10 ноября 2019 - 29 февраля 2020 Опыт получения альгологически чистой культуры Tetraselmis viridis Rouch. в нестерильных условиях
Горбунова С.Ю., Тренкеншу Р.П. Svetlana Yu. Gorbunova, Rudolf P. Trenkenshu
Федеральный исследовательский центр
УДК 581.1:57.032:57.033
Экспериментально показана возможность получения альгологически чистой культуры Tetraselmis viridis, выращиваемой в нестерильных условиях на черноморской воде. При невысокой начальной плотности культуры через 1–3 суток наблюдалось заражение культуры сине-зелёной микроводорослью Oscillatoria sp. Трехкратное механическое удаление клеток сине-зелёных микроводорослей путем фильтрации зараженной культуры позволило получить альгологически чистую культуру T. viridis. При аналогичных условиях выращивания T. viridis, но при начальном добавлении NaCl (15 г/л) в питательную среду для повышения солёности до средиземноморского уровня, заражения культуры не происходило. Ключевые слова: морские микроводоросли; Tetraselmis viridis; альгологическая чистота культуры
Введение При интенсивном выращивании какого-либо вида микроводорослей в открытых системах культивирования, часто возникает проблема заражения культуры другими нежелательными видами микроводорослей. Особенно эта проблема актуальна при промышленном выращивании, в бассейнах больших объёмов, когда используются нестерильные условия культивирования. С такой проблемой пришлось столкнуться при разработке недорогой технологии массового выращивания зелёной микроводоросли Tetraselmis viridis Rouch. на черноморской воде (Жондарева, Тренкеншу, 2019). Этот вид представляет интерес как живой корм для объектов аквакультуры (Спекторова, 1970) и особенно для ценных пород рыб, которые испытывают потребность в пигментах и полиненасыщенных жирных кислотах (Kleivdal et al., 2013). Tetraselmis viridis, как морской вид, относится к наиболее перспективным источникам биологически ценных продуктов из микроводорослей (Das et al., 2016), которые стимулируют рост и выживаемость личинок рыб, повышают качество конечной продукции. Особенно у морских видов микроводорослей подчёркивается высокое содержание полиненасыщенных жирных кислот (Pulz, Gross, 2004; Griffiths et al., 2012; Kleivdal et al., 2013), которые важны не только для аквакультуры, но и для здоровья человека, особенно ω3 и ω6 кислоты (Bucher et al., 2002; Whelan, 2009; Ulmann et al., 2017). Возможность устойчивого непрерывного роста Tetraselmis viridis в хемостате показана в работе (Силкин и др., 1977). Для этого вида предложена питательная среда, позволяющая получать устойчивый непрерывный рост морских микроводорослей в плотной культуре, однако для некоторых видов необходимо использовать инокулят повышенной плотности, чтобы избежать заражения культуры посторонними видами на начальном этапе выращивания (Тренкеншу и др., 1981). При массовом культивировании T. viridis опасность заражения культуры нежелательными видами значительно возрастает из-за нестерильных условий. В этом случае можно использовать механический способ очистки культуры, удаляя нежелательные клетки из системы культивирования. Другим вариантом недопущения заражений может служить способность Т. viridis, в отличие от некоторых других видов микроводорослей, расти на среде с высокой концентрацией NaCl. Исследования, приведённые в работе (Стриж и др., 2004), указывают на то, что клетки микроводоросли Т. viridis хорошо растут в средах различной солёности (в диапазоне концентраций NaCl от 0,01 М до 1,2 М), это может позволить избежать заражения культуры в процессе выращивания. В предлагаемой статье описан экспериментальный способ механической очистки нестерильной культуры Tetraselmis viridis от сине-зелёной микроводоросли путём фильтрации. Приведены данные роста Т. viridis на среде с удвоенной солёностью, которая позволяет избежать заражения сине-зелёной микроводорослью Oscillatoria sp.
Материалы и методы В опытах использовали альгологически чистую культуру Tetraselmis viridis (Rouchijajnen) R.E.Norris, Hori & Chihara, 1980 (Guiry, Guiry, 2019) – штамм IBSS-25 из ЦКП «Коллекция гидробионтов Мирового океана» ФИЦ «Институт биологии южных морей имени А.О. Ковалевского РАН». Tetraselmis (=Platymonas) viridis Rouch. впервые был описан (Роухияйнен, 1966) и выделен в культуру из Черного моря. Питательная среда готовилась на основе нестерильной черноморской воды. Используемая вода имеет солёность 1,4–1,8‰ и лежит в диапазоне оптимальных значений (Спекторова, 1970; Стриж и др., 2004). В опытах с повышенной солёностью в среду добавляли 15 г/л NaCl. Состав среды для культивирования T. viridis в плотной культуре приведен в работе (Тренкеншу и др., 1981). Данная питательная среда рассчитана на достижение плотности культуры до 4–6 г (сухой биомассы)/л; при работе с пониженными или повышенными плотностями концентрации всех элементов следует пропорционально изменить. Необходимо заметить, что при переводе культуры на данную среду требуется время для адаптации, которое может достигать 3–4 суток, аналогичное время требуется при переходе микроводорослей на миксотрофный тип питания (Жондарева, Тренкеншу, 2016). T. viridis выращивали накопительным методом в двух стеклянных культиваторах плоскопараллельного типа (Тренкеншу и др., 2017), с рабочим объёмом 3 л при боковом поверхностном освещении 10 кЛк. Освещённость поверхности фотобиореакторов определяли люксметром Ю-116. C целью компенсации испарения воды на протяжении всего эксперимента поддерживали этот объём, доливая перед измерениями дистиллированную воду до отметки 3 л. Скорость продувки воздухом через распылители в культуре составляла 1л·мин-1·л-1. Температура среды автоматически поддерживалась на уровне 24ºС, которую контролировали ртутным термометром непосредственно в культиваторе, абсолютная погрешность измерений составляла ±0,5ºС. Для засева экспериментальных культиваторов использовали активно делящуюся культуру, начальная плотность составляла 0,05 г/л сухого вещества. Оптическую плотность рассчитывали по формуле: D = -lg(T), где Т – величина пропускания, определяемая на Unico 2100 (United Products & Instruments, USA) при длине волны 750 нм, абсолютная погрешность при измерении величины пропускания не превышала 1,0%. Параллельно аналогичные измерения производили с помощью прибора КФК 2. Показания плотности на разных приборах не выявили различий, превышающих абсолютную погрешность. При пересчёте единиц оптической плотности на сухой вес микроводорослей (СВ) использовали эмпирически определённый коэффициент k, равный 0,8 г·л-1 ед.опт.пл-1; CB = k × D750·0,8 (Боровков, Геворгиз, 2005). Определение плотности по сухому весу и подсчет концентрации клеток в камере Горяева производили в пятикратной повторности по методикам, описанным в работе (Владимирова, Семененко, 1962). Микроскопический контроль культуры производили с помощью светового микроскопа Carl Zeiss Axiostar Plus (Carl Zeiss, Германия). Математическую обработку и моделирование экспериментальных данных осуществляли с помощью компьютерных программ Grapher3 и Excel.
Результаты и обсуждение Основанием для проведения экспериментов послужили периодические заражения культуры морских микроводорослей посторонними видами после внесения инокулята в систему культивирования, аналогичную описанной в работе (Жондарева, Тренкеншу, 2019). Для выяснения динамики заражения и возможности очистки культуры Tetraselmis viridis от нежелательных видов проведен опыт, результаты которого приведены на рис. 1.
Рис. 1. Динамика плотности зараженной культуры T. viridis (г/л). Стрелками отмечены моменты фильтрования биомассы микроводорослей и удаления цианобактерий Fig. 1. Dynamics of the density of the contaminated culture of T. viridis (g/l). The arrows marked the moments of filtering the biomass of microalgae and the removal of cyanobacteria
При ежедневном микроскопическом контроле заражение культуры Tetraselmis viridis замечено на 5 сутки выращивания. Были обнаружены единичные прямые, сине-зелёные клетки цианобактерии Oscillatoria sp., длина трихом составила в среднем 50 мкм. На шестые сутки зафиксирована вспышка роста цианобактерий. Учитывая, что размеры клеток тетраселмиса варьировали в пределах 7,46±0,28 мкм по ширине и 8,42±0,28 мкм по высоте, что значительно ниже длины трихом цианобактерий, для удаления последних из культуры применили метод фильтрации. С помощью мельничного газа №40 (диаметр ячейки 40 мкм) все содержимое культиватора профильтровали, предварительно измерив плотность микроводорослей. После удаления задержавшейся на фильтре биомассы Oscillatoria sp. повторно измерили плотность культуры. Потеря составила 9,4±0,28% от общей величины абсолютно сухого веса микроводорослей в культиваторе. На седьмые и восьмые сутки провели те же манипуляции. Концентрация удалённой биомассы Oscillatoria sp. составила 4,2±0,11% и 0,9±0,05% соответственно. Последующие шесть суток эксперимента в культиваторе продолжала расти чистая культура T. viridis. В опыте с повышенной соленостью среды заражения культуры Tetraselmis viridis посторонними видами не зафиксировано, несмотря на полностью идентичные по всем характеристикам условия выращивания. Накопительная кривая роста показана на рис. 2.
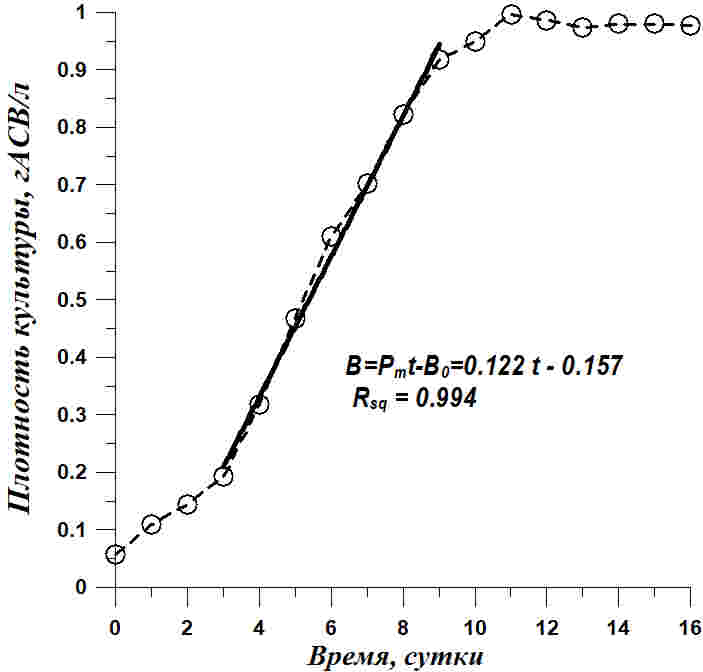
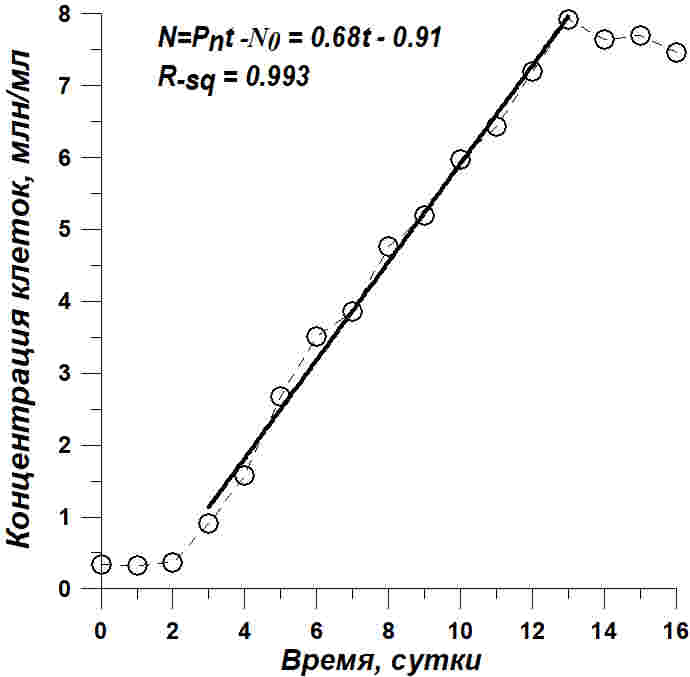
Рис. 2. Динамика роста Tetraselmis viridis на питательной среде, приготовленной на черноморской воде с добавлением 15 г/л NaCl. Светлые кружочки – экспериментальные данные, сплошная линия – расчетные прямые по уравнениям, показанным на рисунках и в тексте Fig. 2. Tetraselmis viridis growth dynamics on a nutrient medium on the Black Sea water with the addition of 15 g/l NaCl. Light circles – experimental data, solid line – calculated straight line calculated by equations shown in Figures and in the article
Из приведенных данных видно, что рост Tetraselmis viridis на среде с повышенной соленостью характеризуется наличием длительной линейной фазы. Но концентрация клеток линейно росла в течение 10 суток и увеличилась в 8 раз, а плотность культуры в абсолютно сухом весе выросла примерно в 5 раз за 7 суток линейного роста. Линейный рост формально хорошо описывается уравнением прямой (Тренкеншу и др., 2018) как для концентрации клеток (N), так и для плотности культуры (B): В уравнениях приняты следующие обозначения: t – время от начала культивирования, сутки; PN , Pm – скорость увеличения концентрации клеток (млн кл.·л-1·сут-1) и плотности культуры (г АСВ·л-1·сут-1), соответственно; N0 , B0 – коэффициенты. Расчет коэффициентов по уравнениям линейного роста при количественном описании динамики роста в эксперименте с повышенной солёностью среды показал, что продуктивность культуры составляет 0,122 гАСВ с одного литра в сутки. Эта величина при пересчете на освещаемую поверхность (слой 5 см) дает значение 6,1 гАсв/(м2сутки), что соответствует продуктивности Tetraselmis viridis для данных световых и углеродных условий (Тренкеншу и др., 1981; Raes et al., 2014). За 16 суток выращивания T. viridis на питательной среде, приготовленной на черноморской воде с добавлением 15 г/л NaCl, был получен урожай микроводорослей в количестве 2,76±0,08 г сухого вещества с 3 литров суспензии, в варианте с применением метода фильтрации – 2,47±0,07. Повышение концентрации NaCl в питательной среде при организации процесса выращивания T. viridis позволяет предотвратить заражение культуры другими видами микроводорослей и избежать дополнительных затрат времени, материальных средств и механического труда. Кроме того, становится возможным получить урожай одного и того же вида микроводорослей, превосходящий по некоторым кинетическим параметрам культуру, выращенную при прочих одинаковых условиях.
Заключение Представлены экспериментальные результаты по очистке культуры Tetraselmis viridis от заражения посторонними видами при нестерильном выращивании на черноморской воде. Предложен метод фильтрования для получения альгологически чистой культуры T. viridis на начальном этапе выращивания в нестерильных условиях. Показано, что увеличение солёности среды, приготовленной на черноморской воде с добавкой 15 г/л NaCl, препятствует заражению культуры как на начальном этапе культивирования, так и в процессе выращивания без потери продукционных свойств T. viridis.
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье. Работа выполнена в рамках в рамках госзадания ФИЦ «Институт биологии южных морей им. А.О. Ковалевского РАН» (№ гос. регистрации АААА-А18-118021350003-6).
Список литературы
Статья поступила в редакцию 15.01.2020
Об авторах Горбунова Светлана Юрьевна - Gorbunova Svetlana Yu. кандидат биологических наук svetlana_8423@mail.ru Тренкеншу Рудольф Павлович – Trenkenshu Rudolf P. кандидат биологических наук r.trenkenshu@rambler.ru Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФИЦ ИнБЮМ РАН; тел. (8692)550795.
ССЫЛКА НА СТАТЬЮ: Горбунова С.Ю., Тренкеншу Р.П. Опыт получения альгологически чистой культуры Tetraselmis viridis Rouch. в нестерильных условиях // Вопросы современной альгологии. 2020. № 1 (22). С. 94–100. URL: http://algology.ru/1586 DOI - https://doi.org/10.33624/2311-0147-2020-1(22)-94-100 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
Experiment on obtaining an algologically pure culture of Tetraselmis viridis in non-sterile conditions Svetlana Yu. Gorbunova, Rudolf P. Trenkenshu Kovalevsky Institute of Biology of the Southern Seas RAS, Sevastopol, Russia The possibility of obtaining an algologically pure culture of Tetraselmis viridis, grown on the Black Sea water in non-sterile conditions, was shown experimentally. Our experiments showed that at low initial population density of the culture after 1–3 days there was an infection of the culture with blue-green species of microalgae (Oscillatoria sp.). Thrice repeated mechanical removal of blue-green microalgae cells by filtering the infected culture allowed obtaining an algologically pure culture of T. viridis. Under similar conditions of T. viridis cultivation but with the initial addition of NaCl (15 g/l) to the nutrient medium aimed at increasing salinity to the Mediterranean level there was no contamination of the culture. Key words: marine microalgae; Tetraselmis viridis; algological purity of culture.
References
Authors Gorbunova Svetlana Yu. Orcid ID – https://orcid.org/0000-0003-2770-1221 Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia svetlana_8423@mail.ru Trenkenshu Rudolf P. Orcid ID – https://orcid.org/0000-0003-3727-303X Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia r.trenkenshu@rambler.ru
ARTICLE LINK: Gorbunova S.Yu., Trenkenshu R.P. Experiment on obtaining an algologically pure culture of Tetraselmis viridis in non-sterile conditions. Voprosy sovremennoi algologii (Issues of modern algology). 2020. № 1 (22). P. 94–100. URL: http://algology.ru/1586 DOI - https://doi.org/10.33624/2311-0147-2020-1(22)-94-100 Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free. When reprinting a link to the site is required
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||