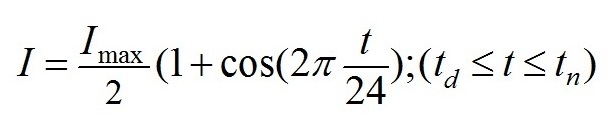|
|
|
Рост Tetraselmis viridis (Rouchijajnen) R.E.Norris, Hori & Chihara 1980 в тепличном бассейне при естественном освещении и аэрации воздухом
Жондарева Я.Д., Тренкеншу Р.П. Yana D. Zhondareva, Rudolf P. Trenkenshu
Федеральный исследовательский центр
УДК 581.1:57.032:57.033
В статье приведены результаты экспериментального обоснования возможности недорогого массового выращивания черноморской микроводоросли Tetraselmis viridis Rouch. Опыты проводились в накопительном режиме культивирования в бассейнах при естественном освещении и подачей углерода в виде перемешивания и аэрирования культуры воздухом без дополнительной подачи углекислоты. Для 8 см освещаемого слоя культуры достигнута плотность около 50 г (сухой массы)/м2 или 88 млрд кл./м2, с продуктивностью 14,4 г (сухой массы)·м-2сут-1 или 19 млрд кл.· м-2сут-1. Ключевые слова: морские микроводоросли; естественный свет; накопительная культура; тепличный бассейн; аэрация воздухом, продуктивность.
Введение Рассматривая микроводоросли как важный природный ресурс, который может обеспечить различные биопродукты для пищевой, нутрицевтической, медицинской, косметической промышленности и аквакультуры (Лось, 2013; Камнев, 2015; Giordano, Wang, 2018), необходимо учитывать экономику процесса их выращивания (Yusoff et al., 2019). Крупномасштабное производство микроводорослей по-прежнему является сложной проблемой, в первую очередь из-за высокой себестоимости биомассы. Дизайн и технология системы культивирования должна быть разработана с использованием энергоэффективных подходов, чтобы максимизировать производство с наименьшими затратами (Fon Sing et al., 2014, Yusoff et al., 2019). Этим требованиям удовлетворяет технология выращивания микроводорослей на естественном освещении. Следующим важным моментом энергоэффективного подхода является применение недорогого динамического перемешивания культуры для максимального использования углекислого газа из атмосферы и питательных веществ из среды (Yusoff et al., 2019). При таких условиях можно получать культуру высокой плотности, что позволяет использовать бассейны небольшой глубины и объема при равных освещаемых площадях (Pruvost, 2017). В последние годы стала бурно развиваться аквакультура ценных пород рыб, появилась потребность в пигментах и полиненасыщенных жирных кислотах (Kleivdal et al., 2013), которые стимулируют рост и выживаемость личинок рыб, повышают качество конечной продукции (Gatenby et al., 2003). К наиболее перспективным источникам биологически ценных продуктов из микроводорослей относятся морские виды (Das et al., 2018). Они особенно богаты полиненасыщенными жирными кислотами (Bucher et al., 2002; Pulz, Gross. 2004; Griffiths et al., 2012; Kleivdal et al., 2013). Вместе с тем медицинские исследования показали важную роль полиненасыщенных жирных кислот для здоровья человека, особенно, ω3 и ω6 кислот (Bucher et al., 2002; Whelan, 2009; Ulmann et al., 2017). Одним из объектов, перспективных для промышленного производства и практического использования можно рассматривать морские одноклеточные водоросли рода Tetraselmis = Platymonas (Guiry, Guiry, 2019). Первые опыты с относительно крупными объемами микроводоросли Tetraselmis suecica показали возможность выращивания этой микроводоросли в закрытых ёмкостях объемом 330 л с погружными источниками света (Knowless, Edwards, 1971). Плотность культуры достигала 0,5 млн кл/мл, но устойчивого непрерывного роста авторам достичь не удалось. В опытах с галотолерантным штаммом водоросли Tetraselmis sp., MUR 233 устойчивый рост наблюдался в течение 5 месяцев в пилотных открытых бассейнах (raceway) при увеличении солености среды. Максимальная продуктивность была достигнута при миксотрофном питании и составила 37,5 г (АСВ)·м-2сут-1 (Fon Sing, 2014). Перспективность массового культивирования морской флагелляты Tetraselmis viridis Rouch. как корма для объектов аквакультуры была обоснована в 1970 г. (Спекторова, 1970). Устойчивый непрерывный рост этого вида микроводорослей был получен в хемостате (Силкин и др., 1977), это позволило авторам изучить некоторые физиологические характеристики. В результате экспериментальных исследований с элементами минерального питания клеток была разработана питательная среда для T. viridis, позволяющая получать устойчивый непрерывный рост микроводоросли в плотной культуре (Тренкеншу и др., 1981). В предлагаемой статье рассматривается экспериментальное обоснование возможности массового культивирования микроводоросли Tetraselmis viridis при минимальных технических и технологических затратах производства.
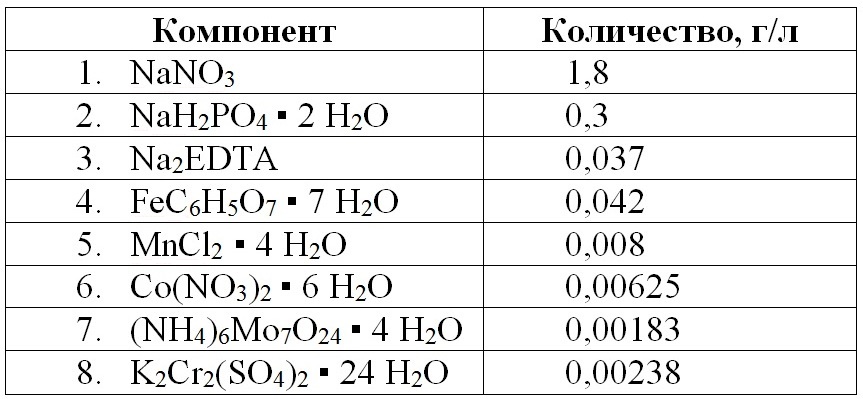
Материалы и методы Объект. В опытах использовали альгологически чистую культуру Tetraselmis viridis (Rouchijajnen) R.E.Norris, Hori & Chihara, 1980 – штамм IMBR-25 из ЦКП «Коллекция гидробионтов Мирового океана» ФИЦ «Институт биологии южных морей имени А.О. Ковалевского РАН». Tetraselmis (=Platymonas) viridis Rouch. впервые был описан (Роухияйнен, 1966) и выделен в культуру из Черного моря (Ланская, 1971). Питательная среда. Питательная среда готовится на основе пастеризованной черноморской воды. Используемая вода имеет соленость 1,4–1,8% и лежит в диапазоне оптимальных значений (Спекторова, 1970, Стриж и др., 2004). Данная питательная среда рассчитана на достижение плотности культуры до 4–6 г (сухой биомассы)/л; при работе с пониженными или повышенными плотностями, концентрации всех элементов следует пропорционально изменить. Необходимо заметить, что при переводе культуры на данную среду требуется время для адаптации, которое может достигать 3–4 суток, аналогичное время требуется при переходе микроводорослей на миксотрофный тип питания (Тренкеншу, Жондарева, 2017).
Таблица 1. Состав среды для культивирования T. viridis (Тренкеншу и др., 1981)
Культиватор. Для экспериментов использовали неглубокие (до 18 см) бассейны прямоугольной формы размером 0,5Х 1 м, выстеленные полиэтиленовой пленкой. Перед экспериментом культиваторы стерилизовали ультрафиолетовой лампой в течение 1 часа. Фактически культиватор представляет собой горизонтальный плоскопараллельный слой суспензии с регулируемой глубиной освещаемого слоя. Глубина слоя суспензии в опытах поддерживалась на уровне 8 см (объём – 40 л), с ежедневной компенсацией испарившейся воды. В одном из углов расположен аквариумный компрессор «Resun» ACO-006, который перемешивает суспензию и обеспечивает газообмен с внешней средой. Т.е. в опытах использован наиболее простой и дешевый культиватор.
Альготехнологический модуль. Представляет собой обычную теплицу с коммуникациями размером 3Х4 м и высотой около 3 м, в которой расположены культиваторы.
Рис. 1. Альготехнологический модуль для полупромышленного выращивания микроводорослей отдела биотехнологий и фиторесурсов ФИЦ ИнБЮМ, г. Севастополь (фото – Лелеков А.С.) Fig. 1. Alga technology module for semi-industrial cultivation of microalgae in the Department of biotechnology and phytoresources of FIC IBSS, Sevastopol (photo – Lelekov A. S.)
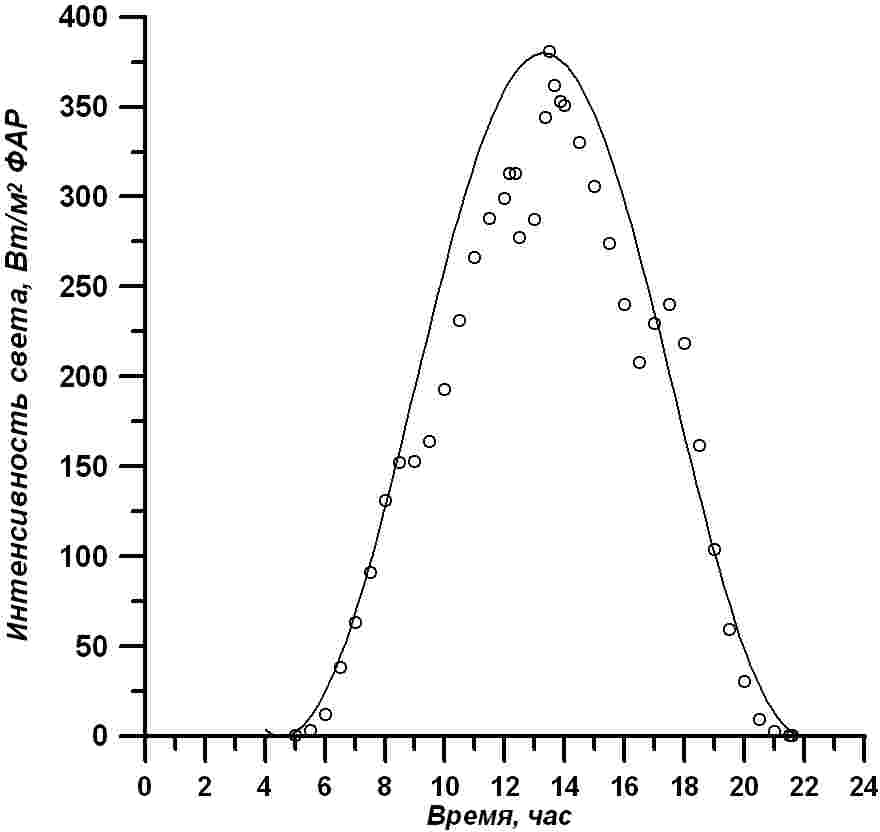
Световые условия. Фотоавтотрофный рост микроводорослей обеспечивался только естественным освещением. Начало эксперимента в день летнего солнцестояния – 22 июня 2018 г., в этот день наблюдается максимальная инсоляция поверхности земли. На протяжении недельного опыта стояли ясные солнечные дни. Измерения на поверхности бассейнов (Чекушкин и др, 2018) подтвердили, что в течение дня их освещенность в области фотосинтетически активной радиации (ФАР) была близкой к расчетной для г. Севастополя. Для расчетов использована формула для оценки ФАР на поверхности озер и океана (Golterman, 1975; Jong-Gyu, Eung-Kwon, 2010; Frouin, 2018): В формуле использованы следующие обозначения: I – интенсивность ФАР на поверхности бассейна, I max – максимальное значение ФАР в астрономический полдень, t – астрономическое время, td , tn – время восхода и заката по астрономическому времени.
Рис. 2. Изменение освещенности поверхности бассейна в течение суток. Светлые кружочки – измеренные значения (Чекушкин и др., 2018), Fig. 2. Changing the illumination of the pool surface within a day. Light circles – measured values (Chekushkin et al., 2018), solid curve – calculated (formula 1) for the latitude of Sevastopol
Температурный режим. Основная проблема теплиц — это перегрев культуры при высокой освещенности. Снижение температуры в культуре происходит за счет активной продувки суспензии воздухом и непринудительной вентиляции самой теплицы. Кроме того, снижение температуры микроводорослевой суспензии предусмотрено теплообменниками в виде шлангов, погруженных в культуру, за счет прокачки через них воды из моря. В наших опытах температура культуры в дневное время поддерживалась на уровне 27–30°С, что соответствует оптимальному диапазону (Спекторова, 1970; Ланская, 1971). Методы контроля роста. Контроль роста производился тремя независимыми методами: по изменению оптической плотности культуры, подсчетом концентрации клеток и определением абсолютно сухой массы в единице объема культуры. Величину оптической плотности суспензии (в трех повторностях) измеряли в области 750 нм на фотометре Unico 2100 (United Products & Instruments, USA) в кюветах с рабочей длиной 0,5 см; абсолютная погрешность не превышала 1%. Параллельно аналогичные измерения производили с помощью прибора КФК-2. Показания плотности на разных приборах не выявили различий, превышающих абсолютную погрешность. Оптическую плотность слоя суспензии (8 см) получали путем умножения значений плотности в кювете (0,5 см) на 16 (Новикова, 2017). Концентрацию клеток в единице объема (пятикратная повторность) измеряли путем подсчета в камере Горяева (Владимирова, Семененко, 1962). Плотность культуры (пятикратная повторность) измеряли путем центрифугирования 10 мл суспензии в пробирках, слива супернатанта и высушивания остатка при 105°С. Разность веса пробирок до и после высушивания представляет величину плотности культуры относительно использованного объема (10 мл) культуры (Владимирова, Семененко, 1962, Методы ..., 1975). Измерения производили ежесуточно. Математическая обработка полученных данных осуществлялась с помощью компьютерной программы «Grapher3» и электронных таблиц Excel.
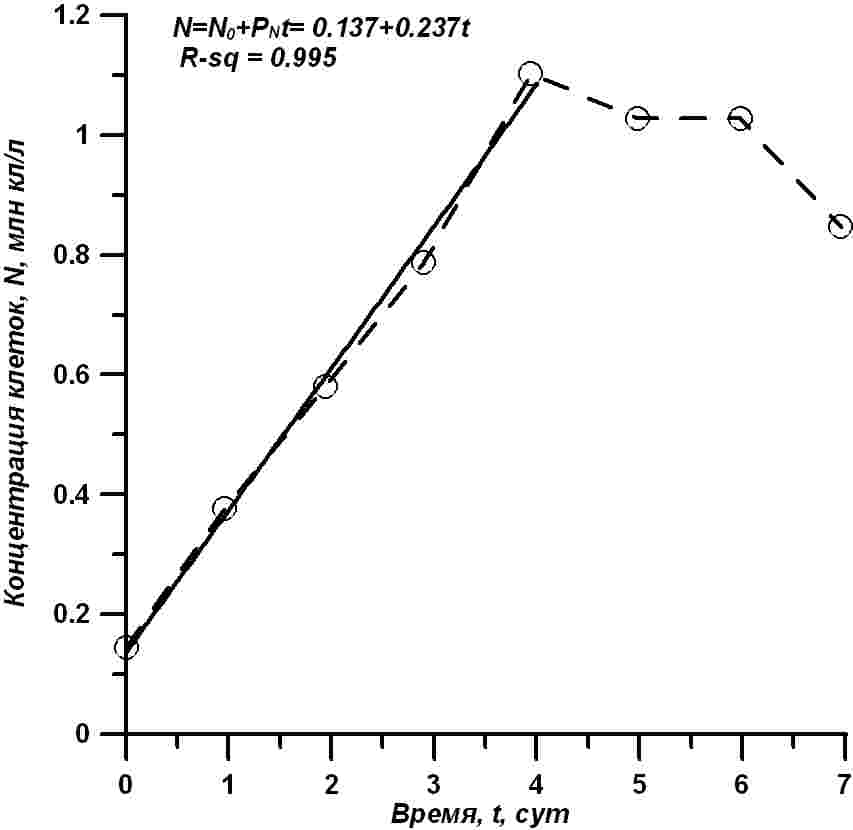
Результаты и обсуждение Динамика роста концентрации клеток в экспериментальной культуре T. viridis показана на рис. 3. Как видно из приведенных данных, культура показывает устойчивый непрерывный рост в течение первых четырех суток. За это время концентрация клеток превысила 1 млн кл./мл, т.е. увеличилась примерно в 8 раз. После запуска (концентрация N0 = 0,137 млн кл./мл), в течение первых четырех суток (t), концентрация клеток (N, млн кл./мл) растет практически линейно, со скоростью (Pn) = 237 тыс. кл./(мл·сутки). Этот рост хорошо описывается уравнением прямой (Тренкеншу, 2018):
Рис. 3. Динамика роста концентрации клеток T. viridis в эксперименте. Светлые кружочки – экспериментальные измерения, сплошная линия – расчет по формуле (2) Fig. 3. Dynamics of growth of T. viridis cell concentration in the experiment. Light circles – experimental measurements, solid line – calculation by the formula (2)
Обычно плотность и продуктивность культуры рассчитывается по отношению к освещаемой поверхности. В данном опыте под квадратным метром (слой 8 см) находится 80 л суспензии, достигнута максимальная плотность культуры – 1,1 млн кл./мл, или 88 млрд кл./м2, а продуктивность Pn = 0,237 млн кл.·мл-1сут-1= 19 млрд кл.·м-2сут-1.
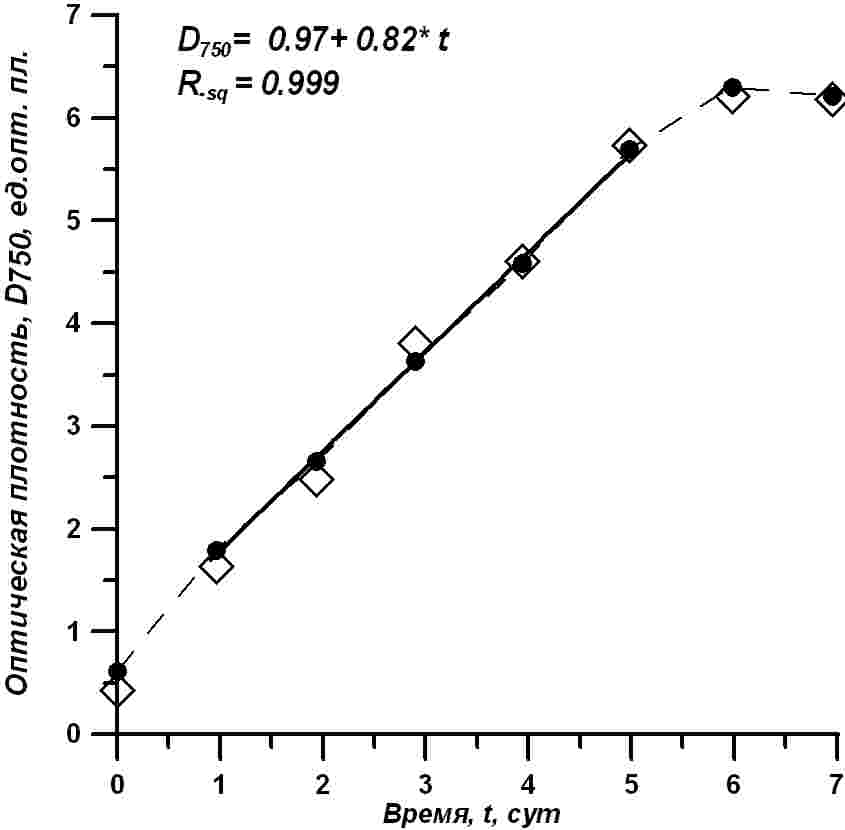
Аналогичная картина наблюдается и для динамики оптической плотности культуры в области 750 нм. Изменение оптической плотности (D750.) в процессе роста T. viridis показано на рис. 4. Как видно из приведенных данных, оптическая плотность культуры показывает устойчивое непрерывное возрастание в течение первых шести суток. Причем оптическая плотность за это время практически увеличилась более чем в десять раз, изменяясь от 0,5 до 6 ед. опт. пл.
Рис. 4. Динамика роста оптической плотности суспензии T. viridis в эксперименте. Светлые ромбики – данные прибора КФК-2, черные кружочки – данные прибора Unico 2100, сплошная линия – расчет по уравнению (3), представленному на рисунке Fig. 4. Dynamics of growth of optical density of T. viridis suspension in the experiment. Light diamonds – data of the device КФК-2, black circles – data of the device Unico 2100, a solid line – calculation according to the equation shown in the Figure
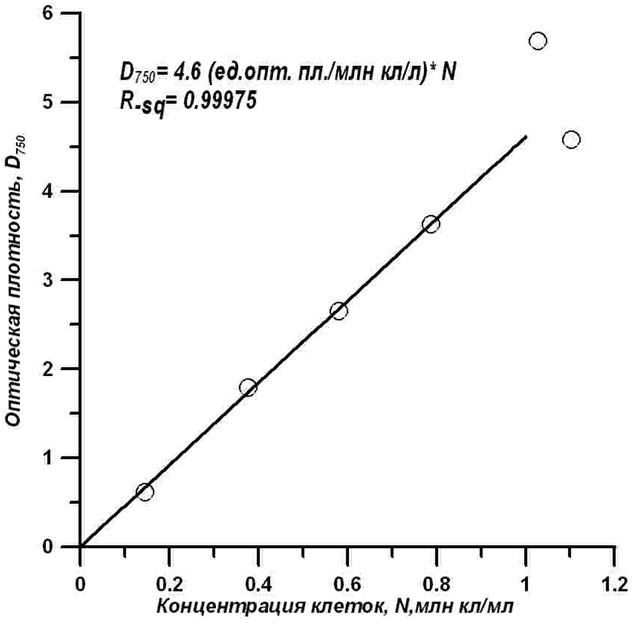
В диапазоне времени роста, с первых по пятые сутки, данные хорошо (Rsq=0,999) описываются линейным уравнением: Линейный рост концентрации клеток и оптической плотности культуры в относительно широком диапазоне значений может указывать на высокую корреляцию между этими измеряемыми параметрами культур. Сопоставляя измеренные значения, удалось обнаружить высокую корреляцию между концентрацией клеток и оптической плотностью культуры для диапазона концентраций от нуля до 1 млн кл./л (рис. 5).
Рис. 5. Связь оптической плотности D750 восьмисантиметрового слоя суспензии с концентрацией клеток в растущей культуре T. viridis Fig. 5. The dependence of optical density D750 of 8 cm layer of the suspension on the cell concentration in the growing culture of T. viridis
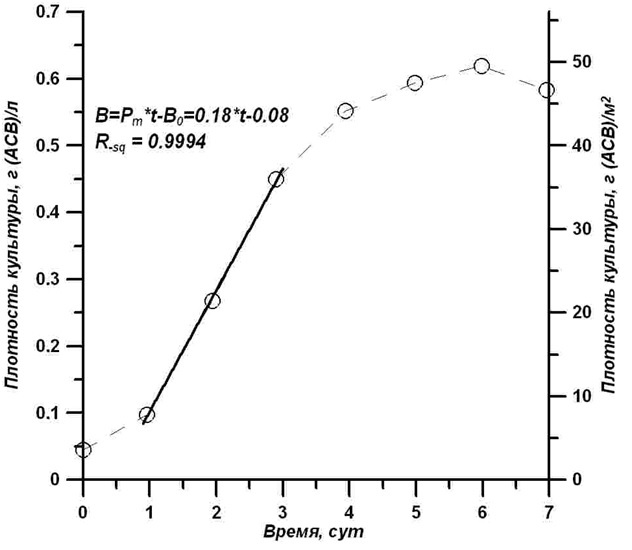
Найденная связь позволяет недорогим оптическим способом осуществлять непрерывный контроль и управление плотностью культуры при переходе к квазинепрерывному процессу выращивания T. viridis. Накопительная кривая роста биомассы (в сухом виде) представляет собой типичную сигмоидную зависимость. Плотность культуры за 6 суток роста увеличилась примерно в 12 раз и достигла 0,62 г (АСВ)/л или 49 г (АСВ)/м2 (рис. 6).
Рис. 6. Динамика роста биомассы в накопительной культуре T. viridis. Светлые кружочки – экспериментальные измерения, сплошная линия – расчет по формуле (4) Fig. 6. The dynamics of biomass growth in the cumulative culture of T. viridis. Light circles – experimental measurements, solid line – calculation by the formula (4)
Диапазон линейного роста концентрации биомассы платимонаса значительно уже, чем для концентрации клеток и ограничен двумя сутками. Полученные данные указывают на диапазон плотностей, внутри которых реализуется максимальная скорость продукции биомассы (Pm) при использовании предложенной недорогой технологии выращивания T. viridis. На рис. 6 выделен диапазон плотностей от 0,1 до 0,45 г (АСВ)/л, при котором наблюдается линейный рост плотности культуры, Экспериментальные данные можно описать простым уравнением (Тренкеншу и др., 2018): Полученное в эксперименте значение максимальной продуктивности Рт = 0,18 г (АСВ)/л/сут, соответствует Рт = 14,4 г (АСВ)·м-2сут-1. Достигнутая продуктивность сравнима с аналогичными опытами других авторов (Raes et al., 2014), но ниже максимальных значений, полученных в опытах при использовании дополнительных источников углерода (Raes et al., 2014, Fon Sing, 2014). Можно утверждать, что в наших опытах лимитирующим скорость роста фактором является углеродное обеспечение клеток. Дополнительное увеличение углеродного питания при данных световых условиях может увеличить продуктивность, но повысит себестоимость получаемой биомассы. Найденное уравнение для динамики плотности культуры позволяет сделать выбор технологического метода квазинепрерывного промышленного выращивания T. viridis. Удобным и дешевым способом можно считать ежедневный отбор части объема культуры, доливая такой же объём свежей питательной среды. Этот объём должен обеспечить плотность, не выходящую за пределы линейной фазы роста, что даст максимальную продуктивность культуры. Начальный и конечный результат эксперимента иллюстрирует рис. 7. Рис. 7. Фото бассейна с культурой T. viridis в начале (слева) и в конце (справа) эксперимента Fig. 7. Photo of the pool with T. viridis culture at the beginning (left) and at the end (right) of the experiment (Photo – Zhondareva Y.D.)
Выводы
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье. Работа выполнена в рамках госзадания ФИЦ «Институт биологии южных морей им. А.О. Ковалевского РАН» (№ гос. регистрации АААА-А18-118021350003-6).
Список литературы
Статья поступила в редакцию 13.06.2019
Об авторах Жондарева Яна Дмитриевна – Zhondareva Yana D. младший научный сотрудник, ФИЦ «Институт биологии южных морей имени А.О. Ковалевского РАН», Севастополь, Россия (FIC «Kovalevsky Institute of Biology of the Southern Seas RAS», Sevastopol, Russia), Отдел биотехнологий и фиторесурсов. yana.zhondareva@yandex.ru Тренкеншу Рудольф Павлович – Trenkenshu Rudolf P. кандидат биологических наук r.trenkenshu@rambler.ru Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФИЦ ИнБЮМ; тел. (869)-2550795.
ССЫЛКА НА СТАТЬЮ: Жондарева Я.Д., Тренкеншу Р.П. Рост Tetraselmis viridis (Rouchijajnen) R.E.Norris, Hori & Chihara 1980 в тепличном бассейне при естественном освещении и аэрации воздухом // Вопросы современной альгологии. 2019. № 3 (21). С. 76–87. URL: http://algology.ru/1566 DOI - https://doi.org/10.33624/2311-0147-2019-3(21)-76-87
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
Growth of Tetraselmis viridis (Rouchijajnen) R.E.Norris, Hori & Chihara 1980 in the greenhouse pool under natural light and aeration Yana D. Zhondareva, Rudolf P. Trenkenshu FIC «Kovalevsky Institute of Biology of the Southern Seas RAS» (Sevastopol, Russia) The article presents the results of experimental evidence of the possibility of inexpensive mass cultivation of the Black Sea microalgae Tetraselmis viridis Rouch. The experiments were carried out in batch culture in pools under natural light and carbon supply by mixing and air aeration of the culture without additional supply of carbon dioxide. For 8 cm of the illuminated layer of the culture, the density of about 50 g (dry weight)/m2 or 88 billion cells/m2, with the productivity of 14.4 g (dry weight) cells· m-2day-1 or 19 billion cells · m-2day-1 has been reached. Key words: marine microalgae; natural light; accumulative culture; greenhouse pool; air aeration; productivity.
References
Authors Zhondareva Yana D. FIC «Kovalevsky Institute of Biology of the Southern Seas RAS», Sevastopol, Russia yana.zhondareva@yandex.ru Trenkenshu Rudolf P. ORCID - https://orcid.org/0000-0003-3727-303X FIC «Kovalevsky Institute of Biology of the Southern Seas RAS», Sevastopol, Russia r.trenkenshu@rambler.ru
ARTICLE LINK: Zhondareva Y.D., Trenkenshu R.P. Growth of Tetraselmis viridis (Rouchijajnen) R.E.Norris, Hori & Chihara 1980 in the greenhouse pool under natural light and aeration. Voprosy sovremennoi algologii (Issues of modern algology). 2019. № 3 (21). P. 76–87. URL: http://algology.ru/1566 DOI - https://doi.org/10.33624/2311-0147-2019-3(21)-76-87
Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free. When reprinting a link to the site is required
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||