|
|
|
|
По Материалам V Всероссийской научной конференции с международным участием «Водоросли: проблемы таксономии, экологии и использование в мониторинге», посвященной памяти Веры Ивановны Есыревой (Нижний Новгород, 2020) Флуоресцентные методы исследования цианобактериальных сообществ при экологическом мониторинге водных объектов
Григорьева Н.Ю.1, Снарская Д.Д.2 Natalia Yu. Grigoryeva, Dina D. Snarskaya
1Санкт-Петербургский Федеральный исследовательский центр РАН,
УДК 574.24
В работе на нескольких примерах продемонстрированы возможности применения конфокальной лазерной сканирующей микроскопии (КЛСМ) при экологическом мониторинге водных объектов. Рассмотрены такие методы КЛСМ, как спектральная визуализация и микроспектроскопический анализ живых цианобактериальных клеток. Показано, что применение флуоресцентной спектроскопии может в значительной степени облегчить трудоемкий процесс таксономического анализа натурных проб и сделать оперативным мониторинг состояния цианобактериальных сообществ при активном «цветении» водоемов. Ключевые слова: цианобактерии; экологический мониторинг; флуоресцентные методы; конфокальная лазерная сканирующая микроскопия; микроспектроскопия
Введение При экологическом мониторинге водных объектов в периоды активных цианобактериальных «цветений» наиболее важными задачами являются определение видового состава (в первую очередь потенциально токсигенных штаммов) и жизнеспособности цианобактериальных сообществ, вызывающих эти «цветения». Традиционно для решения этих задач используют метод прямого микроскопирования проб, как непосредственно взятых из водоема, так и после их культивирования на минеральных средах. К сожалению, недостатками данной методики являются ее трудозатратность и невозможность автоматизировать процесс. Кроме того, на основании анализа морфологических признаков не всегда удается достоверно определить систематическую принадлежность исследуемых организмов. Применение подобной методики также не дает возможности оценить жизнеспособность обнаруженных цианобактериальных сообществ. Анализ спектров собственной флуоресценции цианобактерий на клеточном уровне с помощью КЛСМ помогает успешно решать указанные проблемы. Отслеживание потенциально токсичных видов цианобактерий, способных вызывать сезонные «цветения» открытых водоемов, по-прежнему остается одной из основных задач экологического мониторинга. В связи с этим разрабатываются новые методики, ориентированные на изучение специфических особенностей фотосинтетического аппарата цианобактерий, позволяющих применять различные спектроскопические методики для оперативной оценки видового состава цианобактериальных сообществ. Недавно была предложена новая методика дифференциации цианобактерий до рода/вида, основанная на строгой зависимости между интенсивностью и формой спектров собственной флуоресценции отдельных живых клеток и родовой принадлежностью цианобактерий (Grigoryeva, Chistyakova, 2018). В рамках данной методики спектры собственной флуоресценции получают методом лямбда сканирования на КЛСМ. Следует отметить, что правильная классификация цианобактерий на основе спектров флуоресценции культуры в целом осложняется наличием изменений в пигментном составе в пределах одного вида, обусловленных физиологическим состоянием культуры (или сообщества) и условиями окружающей среды (Wilhelm et al., 2004). Однако некоторые исследования показывают, что вариации в составе питательной среды и в качестве и количестве световой энергии не вносят существенных изменений в исходные спектры флуоресценции и не могут препятствовать дискриминации видов по спектрам собственной флуоресценции (Bodemer, 2004; Zhang et al., 2006). Для оценки жизнеспособности обнаруженных при экологическом мониторинге цианобактериальных сообществ важно иметь информацию об их физиологическом состоянии. Как известно, физиологическое состояние фотосинтезирующих микроорганизмов неразрывно связано с эффективностью работы их фотосинтетического аппарата. Как ухудшение физиологического состояния может вызвать перестройку фотосинтетической системы, так и деструкция фотосинтетического аппарата неизбежно оказывает негативное воздействие на весь организм в целом (Лысенко и др., 2013). В большинстве случаев нарушение в работе фотосинтетического аппарата, как первый отклик на практически любое абиотическое стрессорное состояние (Mironov et al., 2019), можно обнаружить задолго до того, как воздействие обнаружится на биохимическом уровне (Lytle, Lytle, 2001). Еще с 60-х годов прошлого столетия ученые отмечали, что изменения физиологического состояния клетки цианобактерии, происходящие при ее повреждении, отражаются в соответствующих изменениях спектра собственной флуоресценции отдельных пигментов (Методы…, 1975). Традиционно, для этих целей использовали спектры поглощения и флуоресценции фотосинтетических пигментов культуры в целом, в первую очередь – хлорофиллов а и b и фикобилипротеинов. Однако такие интегральные спектры не способны уловить слабые изменения в состоянии фотосинтетического аппарата клеток, поскольку формируются как среднее для множества клеток в различном физиологическом состоянии. Кроме того, паразитный вклад в интегральный спектр могут вносить и различные флуоресцирующие компоненты, присутствующие в культуральной среде. В настоящее время, неразрушающий спектроскопический анализ, проводимый с помощью КЛСМ на клеточном уровне in vivo, позволяет получить более полную информацию об особенностях отдельных клеток цианобактерий и зарегистрировать даже слабые изменения их физиологического состояния. В последние годы быстрое развитие функциональности конфокальной лазерной сканирующей микроскопии (КЛСМ) открыло ряд новых направлений в клеточной биологии (Pawley, 1995). Помимо простой визуализации, КЛСМ предназначен для количественной оценки и анализа информации. Он позволяет легко определять интенсивности флуоресценции объектов, расстояния между объектами, их площади, а также изменения этих параметров во времени. В частности, он способен обнаруживать и количественно оценивать спектральные сигнатуры флуоресцентных объектов и время жизни флуоресценции. Встроенные программные функции проводят анализ степени колокализации меченых структур или концентрации ионов в образце. Кроме того, существует ряд приложений для количественных исследований динамических процессов в живых клетках, такие как FRAP (восстановление флуоресценции после фотообесцвечивания), FRET (передача энергии флуоресцентного резонанса), фотоактивация и фотопреобразование. Наиболее впечатляющей особенностью современных КЛСМ является возможность снимать спектры флуоресценции с отдельных клеток и органелл – лямбда-сканирование. Одним из направлений применения лямбда-сканирования является исследование спектральных характеристик собственной флуоресценции отдельных живых клеток. КЛСМ микроспектроскопия является наиболее мощным инструментом для исследования физиологических процессов в фотосинтезирующих организмах (цианобактерии, водоросли и высшие растения) in vivo. Исследование спектров собственной флуоресценции на клеточном уровне позволяет установить связь между физиологическим состоянием клеток цианобактерий и их фотосинтетической активностью. Например, изменения спектральных характеристик живых фотосинтезирующих клеток свидетельствуют об изменениях в их физиологическом состоянии и могут применяться для изучения стрессорных состояний и результатов внешних воздействий (Grigoryeva et al., 2018). Значительные различия в спектрах собственной флуоресценции отдельных клеток для различных штаммов могут быть положены в основу атаксономической дифференциации видов цианобактерий (Grigoryeva, 2019).
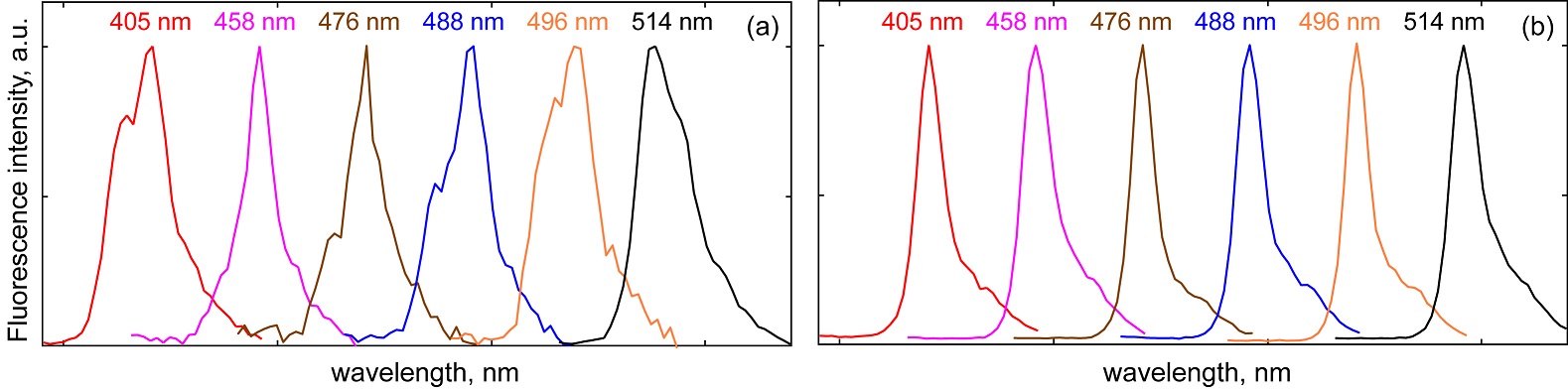
Материалы и методы Натурные пробы Из исследуемого водоема (Капитанского пруда в парке Победы, Санкт-Петербург) стандартными методами были отобраны пробы. Далее материал был подвергнут центрифугированию при скорости 5000 об/мин для получения концентрированных образцов. Препараты для исследования на КЛСМ готовили следующим образом: отбирали 200 мкл материала из пробы и равномерно распределяли между предметным и покровным стеклом. Лабораторные культуры В исследовании были использованы цианобактерии из коллекции CALU Ресурсного центра «Культивирование микроорганизмов» Научного парка Санкт-Петербургского Государственного университета (Pinevich et al., 2004). Цианобактерии, используемые в эксперименте, выращиваются на жидкой среде №6. Стоковую культуру засевали в 30 мл среды и инкубировали в течение 2 недель при комнатной температуре и непрерывном освещении люминесцентными лампами 2000 люкс. Для получения рабочей культуры 2 мл стока добавляли к 30 мл среды, инкубировали в течение недели при комнатной температуре и постоянном освещении белыми флуоресцентными лампами. Конфокальная лазерная сканирующая микроскопия (КЛСМ) Для проведения спектроскопических исследований отдельных клеток цианобактерий использовался конфокальный лазерный сканирующий микроскоп Leica TCS-SP5, оснащенный тремя лазерами: диодным (405 нм), аргоновым (458, 476, 488, 496, 514 нм) и гелий-неоновым (543, 633 нм). Спектры флуоресценции были получены с помощью стандартной операции ламбда-сканирования программного обеспечения ‘Leica Confocal Software’. Серия из пространственных распределений интенсивности флуоресценции с размером 512х512 пикселей снималась при полосе пропускания 6 нм и с шагом 6 нм. Картинки распределений интенсивности флуоресценции снимались одновременно с обычными «светлопольными» изображениями клеток. В качестве объектива использовался иммерсионный объектив с апертурой 1.3 (объектив HCX PL APO 63.0x1.30 GLYC 37°C UV) с глицериновой иммерсией (глицерин 80% H2O). Для лучшего спектрального и пространственного разрешения ламбда-сканирование проводилось с малой частотой развертки 400 Гц в двунаправленном режиме (bidirectional scan mode). При первичной обработке спектров флуоресценции использовалось графическое усреднение по так называемой «области интереса» (ROI), охватывающей отдельную клетку.
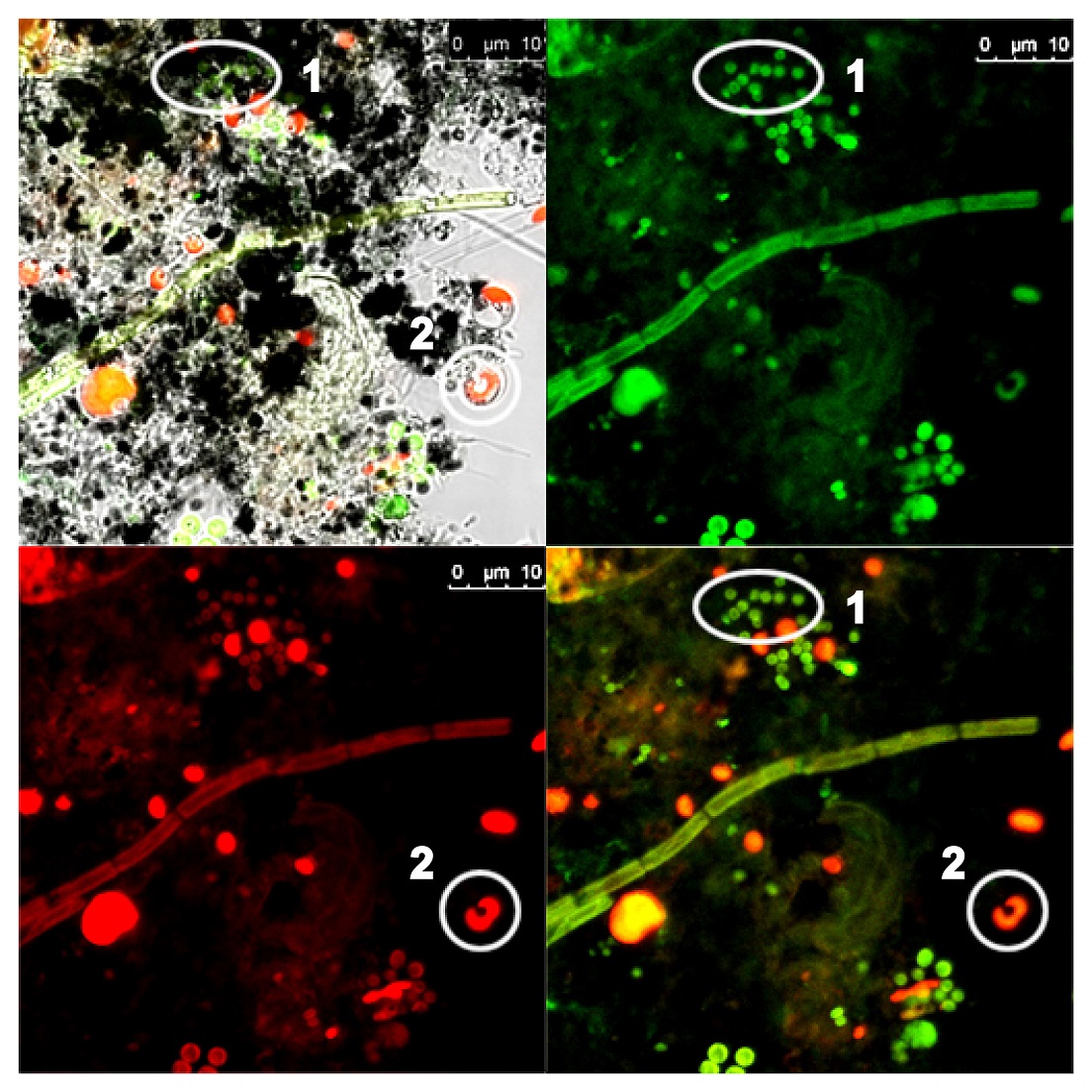
Результаты и обсуждение Дифференциация видов в натурных пробах Как известно, различные виды фитопланктона имеют различное строение фотосинтетического аппарата и разный набор фотопигментов, что и определяет их специфические спектральные характеристики при флуоресцентном анализе. Как было показано в ряде работ (Zhang et al., 2006; Grigoryeva, 2019) эти так называемые «спектральные сигнатуры» позволяют успешно дифференцировать между собой не только большие таксономические группы фитопланктона, но и отдельные виды и штаммы цианобактерий. При анализе натурных проб, важно быстро выделить отдельные классы и провести дифференциацию внутри каждого класса. Применение спектральной визуализации на КЛСМ позволяет сразу выделить различные группы фитопланктона (рис. 1). Например, отдел Cyanobacteria характеризуется наличием фикобилипротеинов (фикоцианина (ФЦ) и аллофикоцианина (АФЦ)) в фотосинтетическом аппарате, поэтому может быть легко выделен в канале длин волн 650–660 нм (рис. 1b), в то время как отдел Chlorophyta в этом канале будет давать минимальный флуоресцентный сигнал. В свою очередь, отдел Chlorophyta имеет сильный флуоресцентный сигнал в области 680–685 нм (флуоресценция хлорофилла а (Хл.а)) (рис. 1с).
Рис. 1. Микроснимки натурной пробы, взятой из Капитанского пруда в парке Победы (Санкт-Петербург).
Наложение различных каналов (рис. 1а и d) дает возможность определить примерный пигментный состав отдельных фотосинтезирующих микроорганизмов, присутствующих в пробе, а также предварительно определить предполагаемый класс или отдел. Например, по рис. 1d можно однозначно идентифицировать отдел Cyanobacteria (область 1) и отдел Chlorophyta (область 2). Цвета на данных снимках присваиваются системой КЛСМ и не несут никакого биологического смысла. Они присваиваются только для различения каналов, а на самом деле вся информация о флуоресцентном сигнале представляет собой ряд черно-белых снимков. Для того чтобы более точно определить таксономическую принадлежность исследуемых объектов можно снять соответствующие спектры флуоресценции отдельных клеток при возбуждении различными длинами волн.
Рис. 2. Спектры флуоресценции отдельных клеток в областях 1 и 2, указанных на рис. 1. Fig. 2. Fluorescence spectra of individual cells in regions 1 and 2 shown in Fig. 1.
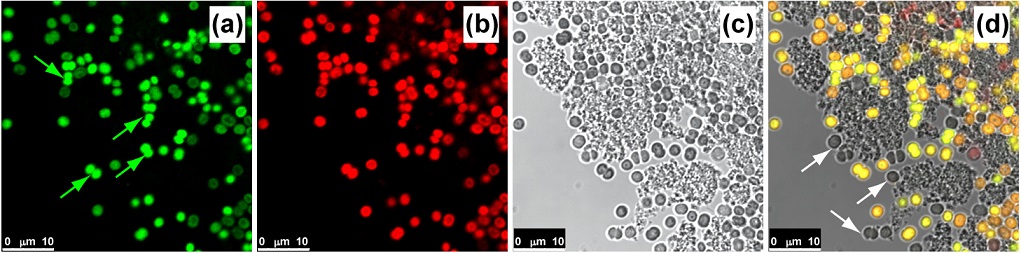
На рис. 2 представлены спектры флуоресценции, снятые с клеток в области 1 (рис. 2а) и в области 2 (рис. 2b). Области соответствуют указанным на рис. 1. Представленные спектры подтверждают сделанный ранее вывод о принадлежности исследуемых объектов соответствующим представителям фитопланктона. Определение жизнеспособности культур На флуоресценцию фотосинтетических пигментов в интактных клетках влияют физико-химические и физиологические процессы, которые происходят как внутри, так и снаружи клеток. В стрессорных состояниях структура и функционирование тилакоидной мембраны могут изменяться. Изменения могут быть как краткосрочными, так и долгосрочными, в зависимости от характера и продолжительности стресса. Динамические изменения в флуоресцентных спектрах живых клеток цианобактерий при различных стрессорных состояниях могут быть обнаружены с помощью КЛСМ и могут использоваться для оценки физиологического состояния и жизнеспособности культур цианобактерий на разных этапах экспериментальных исследований. На рис. 3 представлены изображения, иллюстрирующие совокупность клеток культуры Synechocystis CALU 1336, находящихся в различных физиологических состояниях. Для спектральной визуализации были использованы два спектральных канала флуоресценции и один канал проходящего света. Канал (a), окрашенный в ложный зеленый цвет (присваивается системой КЛСМ), представляет усредненную флуоресценцию фикоцианина (ФЦ) и аллофикоцианина (АФЦ) в диапазоне 650–660 нм, канал (b), окрашенный в ложный красный цвет, показывает флуоресценцию хлорофилла а (Хл. а) в диапазоне 678–710 нм. Наложение каналов (рис. 3d) позволяет выявить мертвые клетки (показаны белыми стрелками). Здесь слабый сигнал в обоих флуоресцентных каналах соответствует молодым клеткам, находящимся в хорошем физиологическом состоянии. Умирающие, старые клетки в плохом физиологическом состоянии имеют высокую флуоресценцию фикоцианина (рис. 3а, зеленые стрелки), а мертвые клетки характеризуются отсутствием флуоресценции (рис. 3d белые стрелки). Молодые, здоровые клетки демонстрируют слабую интенсивность излучения во всем спектральном диапазоне, причем флуоресцентная область расположена на периферии клеток. Это показывает эффективное использование света в фотосинтетических процессах и малые потери на флуоресценцию (Blankenship, 2014).
Рис. 3. Микроснимки культуры цианобактерий Synechocystis CALU 1336, визуализированные с помощью КЛСМ. Зеленый канал (а) представляет флуоресценцию от фикобилинов в области 650–660 нм, красный канал (b) – флуоресценция хлорофилла а в области 678–710 нм, (с) представляет собой светлопольное изображение в проходящем свете, на (d) показано наложение всех трех каналов. Цвета на данных снимках присваиваются системой КЛСМ и не имеют биологического смысла.
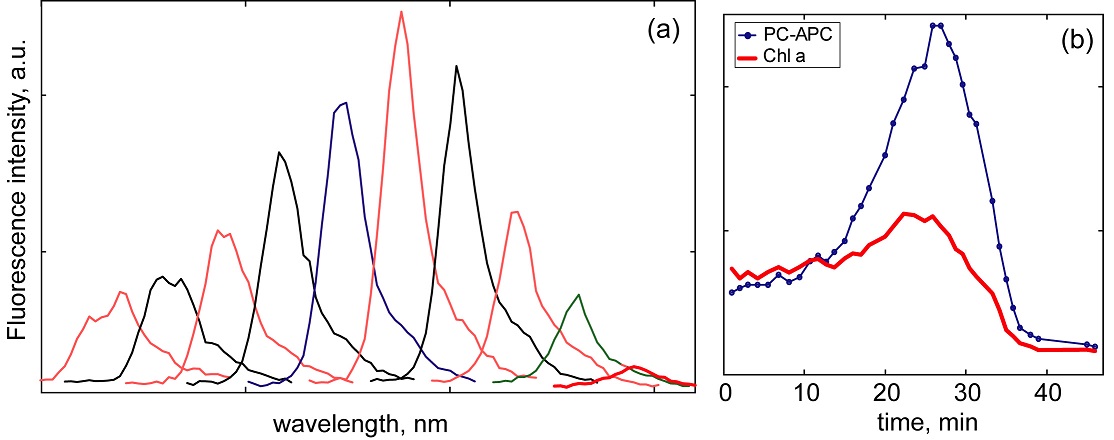
Очевидно, что при деградации (старении или разрушении клеток) происходит не просто изменение интенсивности флуоресценции, но также и формы спектра излучения клеток. Для имитации старения клетки был проведен эксперимент по быстрому разрушению клетки под действием тепловой и световой интоксикации. Как показали наши эксперименты, с точки зрения спектрального состава флуоресцентного сигнала стадии, которые проходит клетка при таком физическом разрушении, аналогичны старению клетки. Рис. 4 иллюстрирует временные изменения спектра флуоресценции in vivo, происходящие в одной живой клетке цианобактерии Synechocystis CALU 1336 при световой и тепловой интоксикации. Длина волны возбуждения в этом эксперименте была 488 нм. Набор спектров был получен с единичной клетки в течение 45 минут с шагом 1 минута (на рисунке представлен только каждый четвертый спектр). Несколько первых минут (1–12 мин) форма спектра меняется незначительно и в основном в диапазоне флуоресценции ФЦ (вблизи 656 нм). Поскольку свет 488 нм поглощается и ФЦ и Хл. а, фотосинтетическая цепь переноса энергии быстро насыщается, и реакционные центры закрываются, поэтому флуоресценция на 656 нм начинает расти. В течение следующих нескольких минут (12–28 мин) наблюдается быстрый рост флуоресценции ФЦ и АФЦ. Это указывает на то, что чрезмерное световое возбуждение приводит к отделению фикобилисом от тилакоидной мембраны, в то время как флуоресценция Хл. а остается почти одинаковой (см. рис. 4b, красная кривая). После 30 минут облучения начинается физическое разрушение отделённых фикобилисом и пигмент-белковых комплексов ФС II. Интенсивность флуоресценции ФЦ и Хл. а уменьшается, а максимум смещается в более коротковолновую область спектра, что свидетельствует о химическом распаде пигмент-белковых комплексов.
Рис. 4. Временная зависимость спектров собственной флуоресценции при деградации живой клетки цианобактерий Synechocystis CALU 1336 в условиях теплового стресса. (а) – спектры, полученные при возбуждении на длине волны 488 нм с временным шагом 4 мин. Спектры смещены вдоль оси X для удобства представления. (b) – зависимость интенсивности флуоресценции ФЦ и АФЦ от времени (на длине волны 656 нм) – тонкая кривая, и флуоресценции хлорофилла а (на 682 нм) – толстая кривая
Заключение В данной работе продемонстрированы преимущества применения конфокальной лазерной сканирующей микроскопии в экологическом мониторинге водных объектов, на примере исследования биологического разнообразия натурных проб и биодеградации клеток лабораторной культуры. Показано, что применение таких методов КЛСМ как спектральная визуализация и микроспектроскопия (лямбда-сканирование) может в значительной степени облегчить трудоемкий процесс анализа натурных проб при оперативном мониторинге цианобактериальных «цветений» водоемов.
Благодарности. Культуры предоставлены Ресурсным центром “Культивирование микроорганизмов” Научного парка СПбГУ. Все исследования проводились на оборудовании Ресурсного центра “Развитие молекулярных и клеточных технологий” Научного парка СПбГУ. Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Список литературы
Статья поступила в редакцию 30.06.2020
Об авторах Григорьева Наталия Юрьевна – Natalia Yu. Grigoryeva кандидат физико-математических наук renes3@mail.ru Снарская Дина Данировна – Dina D. Snarskaya ведущий специалист, Санкт-Петербургский Государственный Университет, Санкт-Петербург, Россия (Saint Petersburg State University, St Petersburg, Russia), Ресурсный центр «Культивирование микроорганизмов» Научного парка СПбГУ dina.snarskaya@spbu.ru Корреспондентский адрес: Россия, 187110, г. Санкт-Петербург, Корпусная ул., 18, Научно-исследовательский Центр экологической безопасности РАН. Телефон (812)499-64-54.
ССЫЛКА: Григорьева Н.Ю., Снарская Д.Д. Флуоресцентные методы исследования цианобактериальных сообществ при экологическом мониторинге водных объектов // Вопросы современной альгологии. 2020. № 2 (23). С. 8–16. URL: http://algology.ru/1623 DOI – https://doi.org/10.33624/2311-0147-2020-2(23)-8-16
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
Fluorescence methods for investigation of cyanobacterial communities during environmental monitoring of water bodies Natalia Yu. Grigoryeva1, Dina D. Snarskaya2 1Saint-Petersburg Federal Research Center of RAS, Scientific-Research Center for Ecological Safety The applicability of confocal laser scanning microscopy (CLSM) for environmental monitoring of water bodies is demonstrated on several examples. Such CLSM methods as spectral imaging and microscopic spectroscopy of living cyanobacterial cells are considered. It is shown that fluorescence spectroscopy application can facilitate time-consuming process of taxonomic analysis of field samples and to make monitoring of water bodies during cyanobacterial blooms, on-line. Key words: cyanobacteria; environmental monitoring; fluorescence methods; confocal laser scanning microscopy; microscopic spectroscopy.
References
Authors Grigoryeva Natalia Yu. Orcid ID – https://orcid.org/0000-0002-0721-0110, РИНЦ Author ID – 641284, eLIBRARY SPIN-код 1197-4472 Saint-Petersburg Federal Research Center of RAS, Scientific Research Center for Ecological Safety, Saint-Petersburg, Russia renes3@mail.ru Snarskaya Dina D. Saint Petersburg State University, St Petersburg, Russia dina.snarskaya@spbu.ru
ARTICLE LINK: Grigoryeva N.Yu.. Snarskaya D.D. Fluorescence methods for investigation of cyanobacterial communities during environmental monitoring of water bodies. Voprosy sovremennoi algologii (Issues of modern algology). 2020. № 2 (23). С. 8–16. URL: http://algology.ru/1623 DOI – https://doi.org/10.33624/2311-0147-2020-2(23)-8-16
Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free.
На ГЛАВНУЮ
|
|||
|
| ||