 |
№ 3 (21) 2019
Обзор методов длительного хранения культур микроводорослей и цианобактерий, используемых в коллекциях Всемирной федерации культур (WFCC) в базе WDCM CCINFO
The review of methods of the long-term storage of microalgae and cyanobacteria cultures used in collections of the world federation of cultures (WFCC)
in WDCM CCINFO base
Харчук И.А.
Irina A. Kharchuk
Федеральный исследовательский центр
«Институт биологии южных морей имени А.О. Ковалевского РАН» (Севастополь, Россия)
УДК 582.26/.27+582.232
Представлена информация о методах длительного хранения микроводорослей и цианобактерий в базе данных мировых коллекций живых культур WDCM CCINFO. Дана краткая информация о каждом методе. Приведены данные о комбинациях способов длительного хранения микроводорослей и цианобактерий, используемых в крупнейших мировых коллекциях.
Ключевые слова: микроводоросли; цианобактерии; методы хранения; WDCM CCINFO; лиофилизация; криосохранение; L-высушивание; обезвоживание; замораживание; иммобилизация.
Введение
Микроводоросли – это внетаксономическая категория низших полифилетичных микроскопических организмов, обитающих преимущественно в водной среде и объединяющая разные систематические группы фототрофов, количество видов в пределах которой постоянно меняется вследствие совершенствования методов исследования, открытия новых видов или ревизии уже описанных таксонов. Ранее цианобактерии относили к царству растений и выделяли в отдел сине-зелёные водоросли. В современной систематике эти организмы входят в Царство Eubacteria, Отдел Cyanobacteria, Класс Cyanophyceae (www.algaebase.org). Как микроводоросли, так и цианобактерии содержат большое количество биологически активных веществ, благодаря чему используются в качестве пищевых добавок, как для человека, так и для животных. Многие виды служат модельными объектами экспериментальных исследований в области биохимии, физиологии и генетики растений (Cock, Coelho, 2011), а также эволюционной биохимии, т.к. являются представителями древних фотосинтетиков (Hohmann-Marriott, Blankenship, 2011) Колоссальное биохимическое многообразие водорослей и относительно легкое культивирование обусловливают их высокий биотехнологический потенциал (Wijffels et al., 2013). Для экспериментальной биологии и биотехнологии большое значение имеют коллекции живых культур. Коллекции микроводорослей и цианобактерий – источники первичного исследовательского материала как для гидробиологии и альгологии, так и для разных областей биологии в целом, депозитарий признанных, перспективных и вероятно перспективных в технологическом отношении объектов, учебный материал при подготовке специалистов-биологов, а также способ сохранения видового и генетического биоразнообразия водорослевого мира, в частности, путем биоконсервации. Их цель – обеспечивать доступность точно идентифицированного, свободного от посторонних микроорганизмов, жизнеспособного материала для исследований. Методы хранения микроводорослей разнообразны, но все они направлены на надежное сохранение культур микроорганизмов и создание генетических банков штаммов, что является центральной задачей современных коллекций микроорганизмов. Эта задача усложняется при увеличении количества депонированных культур. В настоящее время для консервации микроорганизмов используются различные методы. Цель данного обзора – рассмотреть методы длительного хранения водорослей и цианобактерий, а также какие методы и их комбинации применяются в мировых коллекциях культур по базе данных WDCM CCINFO – World Data Centre for Microorganisms, Culture Collections Information Worldwide (Sun et al., 2015; Wu et al., 2017), выявить распространенные комбинации методов.
В основе всех современных методов консервации и длительного хранения коллекционных культур микроорганизмов лежит перевод клеток в анабиотическое состояние с соответствующим ему частичным (хранением на средах с минимальных содержанием питательных веществ, в стерильной посуде, под слоем минерального масла, в дистиллированной воде, при пониженных температурах и др.) или полным (высушивание, лиофилизация, криоконсервация и др.) прекращением метаболизма. Каждый из методов имеет свои преимущества и недостатки и может оказывать различное влияние не только на жизнеспособность, но и на сохранение культурой характерных свойств и физиолого-биохимических и генетических признаков (Сидякина, 1991). Выбор наиболее эффективного способа консервации конкретного организма должен основываться на сохранении культурой жизнеспособности, морфологических признаков, физиологических характеристик, биохимической активности и генетической стабильности с учетом максимально возможного времени хранения культур, а также простоты и надежности реализации данного метода консервации и требований по обслуживанию в течение длительного времени (Duygu et al., 2017). Следует особо подчеркнуть, что сохранение культурой жизнеспособности при консервации некоторыми методами может не коррелировать с сохранением ею активности. Поэтому в ряде случаев при желании сохранить уникальные свойства организма необходимо проводить исследовательскую работу с индивидуальным штаммом с целью оптимизации условий его консервирования (Бекер и др., 1967; Данилова и др., 1967; Сидякина,1988).
В связи с необходимостью разработки комплексных подходов к консервации микроорганизмов, интересно отметить, что практика консервации, развившаяся на протяжении многих десятилетий, эмпирически выработала ряд примеров (табл. 1), в той или иной степени соответствующих тем механизмам погружения клеток микроорганизмов в анабиотическое состояние, которые были выявлены (и продолжают выявляться) при изучении образования, свойств и прорастания специализированных покоящихся клеток микроорганизмов (Калакуцкий, Сидякина,1987; 1988).
Наиболее распространенные методы содержания микроводорослей в коллекциях:
Живые культуры (периодический пересев на жидкие и агаризованные среды
Традиционным методом хранения водорослей является их периодический пересев на свежие питательные среды. Интервал между пересевами зависит от вида водоросли, используемой среды и внешних условий. Некоторые микроводоросли следует пересевать постоянно, другие – только через несколько недель или месяцев. При использовании этого метода для хранения культур должны быть соблюдены три условия: 1) подходящая поддерживающая среда, 2) условия культивирования (температура хранения, освещение, световой режим), 3) необходимая частота пересевов.
Поддержание микроводорослей в коллекциях в жизнеспособном состоянии нуждается в значительных затратах материальных ресурсов и времени и требует высокой квалификации персонала. Кроме того, любая альгологическая коллекция, включая такие известные и признанные как SAG, UTEX, CCAP, сталкивается с явлениями непрогнозируемой гибели культур, с контаминацией штаммов грибами, бактериями, простейшими, другими водорослями, с проблемами ошибок этикеток при пересевах штаммов.
Таблица 1. Сравнение механизмов, реализующихся при переходе в анабиотическое состояние специализированных покоящихся клеток микроорганизмов, с процессами, осуществляемыми при лабораторной консервации культур (Калакуцкий, Сидякина, 1988)
Table 1. Comparison of the mechanisms that are realized during the transition of specialized resting cells of microorganisms to the anabiotic state with the processes carried out during the laboratory cultures conservation (Калакуцкий, Сидякина, 1988)
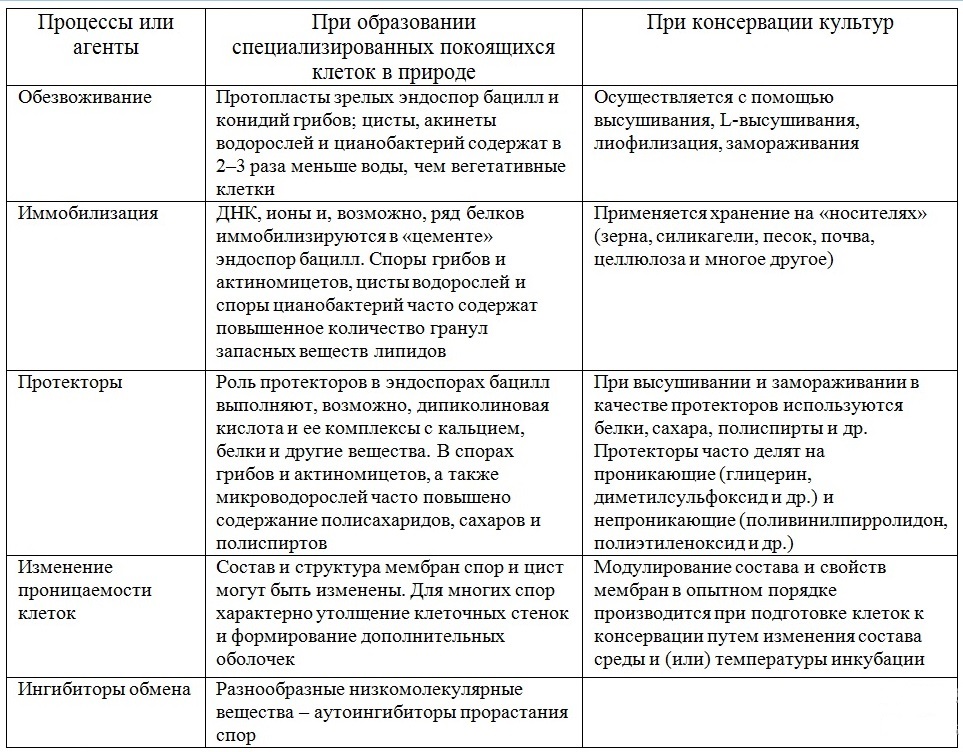
Поэтому современные исследования в области разработки и оптимизации способов поддержания культур микроводорослей в жизнеспособном состоянии сконцентрированы на методах, которые основываются на сохранении культур в состоянии анабиоза (криптобиоза).
Высушивание. Высушивание используется для сохранения микроорганизмов в течение длительного времени. Применяемые способы длительного сохранения культур путем высушивания должны отвечать двум основным требованиям: во-первых, процесс высушивания не должен оказывать вредного воздействия на биологический препарат; во-вторых, сухие препараты должны длительное время сохранять свои биохимические свойства (Колесов, 1952, 1959; Похиленко и др., 2009; Holzinger, Karsten, 2013).
Клетки различных видов микроорганизмов могут быть высушены на воздухе при комнатной или слегка повышенной температуре в стерильной почве, в кварцевом песке, на гранулированной пемзе, на тальке, на активированном угле, на зернах злаков, на дисках агара, на бумаге, на шерстяных нитках и многих других «носителях» и храниться в течение многих лет в жизнеспособном состоянии (Бекер, 1967; Бекер и др., 1981; Hertzberg, 1989; Potts, 1994; Chen, 2001, 2003). В качестве осушителя часто используются обезвоженный силикагель, хлористый кальций или пятиокись фосфора. Применяется высушивание в вакууме и хранение высушенных препаратов при пониженных температурах (Сидякина 1991; Day et al., 1997). Чтобы дольше сохранить жизнь в сухих культурах, используются дополнительные вещества, способствующие защите клеток при экспериментальном высушивании и в процессе хранения. Такими защитными веществами являются белковые коллоиды и некоторые кристаллоиды. Кроме того, к числу защитных факторов необходимо отнести и глубокий вакуум (Viera et al., 1993; Sharma, Kalonia, 2004). Микроорганизмы хранят на фильтровальных дисках, высушенных в вакууме и запаянных в стеклянные ампулы. Данный метод дал хорошие результаты как для хранения прокариотических, так и эукариотических клеток микроорганизмов (Joubert, Britz, 1987).
На примере Chlorella vulgaris Beyerinck, Arthrospira platensis Gomont, Synechococcus elongatus (Nägeli) Nägeli рассмотрено состояние воды в клетках водорослей при обезвоживании, их устойчивость к действию низких температур и обезвоживанию, изучен фотосинтетический аппарат водорослей при анабиозе, а так же проведена их реактивация из сухого анабиоза (Кузьмина, 1990; Нестеренко, Кузьмина, 1982).
а) Лиофилизация. Лиофилизированные культуры могут храниться в течение длительного времени, если их хранить без доступа кислорода, влаги и света при пониженных температурах, обычно при 4°С (Бекер и др., 1981, Cleland et al., 2001). Лиофильная сушка не обеспечивает стопроцентной сохранности жизнеспособности клеток микроорганизмов и не всегда лиофилизация обеспечивает наивысшее качество сухого продукта. Установлено, что процесс лиофилизации приводит к отбору наиболее устойчивых клеток в культуре, которые могут и не обладать желаемыми свойствами (Сидякина, 1991). При лиофилизации на структуры клетки действуют некоторые отрицательные факторы (Аркадьева, 1983):
1) Кристаллы льда механически повреждают оболочку и внутриклеточные структуры. Особую опасность они представляют при медленном замораживании, когда образуются более крупные кристаллы. Напримере, Scenedesmus rubescens (P. J. L. Dangeard) Kessler, Schafer, Hummer, Kloboucek & Huss продемонстрировано, что лиофилизация повреждает клеточную оболочку (Kröger et al., 2019).
2) Из клетки не выделяется часть растворенных в клеточной жидкости электронов, которые при реактивации могут денатурировать белки.
3) При глубоком вакууме молекулы паров воды, обладающие большой кинетической энергией, могут механически повреждать важные участки клеточных структур. Отрицательное действие проходящих через слой биомассы молекул воды под вакуумом научно доказано.
4) В целях устранения чрезмерно глубокого обезвоживания биомассы при лиофилизации применяются сложные защитные среды, содержащие гидрофильные вещества и вещества, защищающие клетки от отрицательного действия низких температур, например глицерин.
5) При лиофилизации образуется пористая структура.
6) Большое число экспериментальных данных показывает, что процесс лиофилизации вызывает мутации многих видов микроорганизмов (McGrath et al., 1978; Сидякина, 1991).
Однако некоторые авторы полагают (Lin, 1985), что лиофилизация обеспечивает большую стабильность, чем высушивание и метод периодических пересевов для широкого круга микроорганизмов, а клетки, которые выдерживают процесс лиофилизации, могут сохранять жизнеспособность в течение многих лет. Опытным путём установлено, что метод лиофилизации успешно применяется для сохранения цианобактерий размножающихся акинетами (спорами), а также для тех видов которые способны синтезировать экзополисахариды (Corbett, Parker, 1976; Day, DeVille, 1995; Park, 2006; Esteves-Ferreira, Corrêa, 2013). Суспензирование клеток с защитным средами перед лиофилизацией повышает количество выживших культур (Corbett, Parker, 1976; Abadias et al., 2001; Park, 2006; Wessman et al., 2013). Для микроводорослей лиофильная сушка была менее успешной, т. к. отмечен низкий уровень жизнеспособности (<1% от первоначальной популяции) и дальнейшее снижение жизнеспособности при длительном хранении (Day, DeVille, 1995). В исследовании McGrath с соавт. (1978) было лиофилизировано 106 штаммов водорослей из отделов Сhlorophyta и Сhrysophyta, 39 из них были успешно реактивированы. Лиофилизацию проводили вместе с защитными агентами (обезжиренное молоко, сахароза, сыворотка крови ягненка или лошади), положительные результаты получены при использовании 20%-ного обезжиренного молока и 12%-ной сахарозы.
Следует отметить, что процесс лиофилизации требует как начальных инвестиционных затрат, так и конкретных практических навыков от персонала (Duygu et al., 2017), при этом она не обеспечивает стопроцентной жизнеспособности сохранняемых клеток микроорганизмов и не всегда обеспечивает наивысшее качество сухого продукта.
б) L–высушивание. Высушивание под вакуумом непосредственно из жидкого состояния используется в последние годы для чувствительных к замораживанию и не переносящих лиофилизацию культур актиномицетов, бактерий, грибов, дрожжей, цианобактерий и некоторых видов водорослей. При использовании этого метода консервации также успешно могут быть использованы различные «носители»: полоски фильтровальной бумаги, комочки хлопковой ваты, кварцевые шарики, гранулы силикагеля, таблетки предварительно лиофилизированного молока, крахмала и другие. Однако для большинства микроорганизмов L–высушивание дает невысокий уровень жизнеспособности. В то же время установлено, что для отдельных видов микроорганизмов падение жизнеспособности при длительном хранении после L–высушивания гораздо меньше, чем после лиофилизации (Sakane, 1982; Сидякина, 1988).
L-высушивание было проверено на девяти штаммах водорослей (Gana et al., 2014). Клетки обезвоживали с использованием свежей культуральной среды и 12%-ной сахарозы в качестве суспендирующей среды. Установлено, что высушивание под вакуумом пригодно для сохранения Anabaena laxa A.Braun ex Bornet & Flahault, A. variabilis Kutzing ex Bornet & Flahault, Aphanothece pallida (Kütz.) Rabenh и Gloeotrichia natans (Sm. & Sowerby) P. G. Richt со свежей культуральной средой или 12%-ной сахарозой в качестве суспендирующей среды. Разные штаммы Hapalosiphon welwitschii W. West, G. S West показали разнообразные реакции на L-высушивание. Так, H. welwitschii BIOTECH 4008 пережил процесс обезвоживания, однако сохранил малое количество жизнеспособных клеток, H. welwitschii BIOTECH 4017 не сохранил достаточного количестав клеток, чтобы считать настоящий метод для данного штамма подходящим. Fischerella ambigua (Kützing ex Bornet & Flahault) Gomont BIOTECH 4006, Spirulina platensis Gomont BIOTECH 4012 и Chlorella sorokiniana Shihira & R.W.Krauss BIOTECH 4016 не смогли восстановиться после L-высушивания. Результаты показывают, что не все сине-зелёные водоросли могут быть сохранены предлагаемым способом, и штаммы в пределах вида могут проявлять различные реакции на процесс. Возможность сохранения методом L-высушивания следует изучать на каждом новом изоляте цианобактерий.
Криоконсервация. Способ состоит в переводе биологических объектов в состояние холодового анабиоза с последующим возвратом их к метаболической активности в физиологически оптимальных условиях культивирования. Согласно большинству известных способов криоконсервации фототрофных микроорганизмов, она осуществляется путем замораживания клеток в различных условиях с последующим их хранением в замороженном состоянии.
В отношении температуры замораживания все известные сегодня способы криоконсервации фототрофных клеток можно разделить на два основных типа: а) способы, предусматривающие хранение клеток при температуре выше температуры жидкого азота, б) способы криоконсервации клеток фототрофных микроорганизмов, предусматривающие хранение клеток при температуре жидкого азота.
Известно, что большинство культивируемых цианобактерий и почвенных микроводорослей могут быть криоконсервированы с относительно высокой жизнеспособностью. Кроме того, многие пресноводные и морские эукариотические водоросли также могут быть криоконсервированы, но с более низким уровнем жизнеспособности после оттаивания. Однако большинство динофлагеллят, криптофитов, синурофитов и рафидофитов не подлежат криоконсервированию (Day, 2007). Морские диатомовые водоросли сохраняют высокую жизнеспособность после оттаивания, в то время как пресноводные диатомовые водоросли оказались менее жизнеспособными. Исследовано большое количество штаммов водорослей, из четырех основных коллекций: CCAP (UK), CCMP (USA), SAG (Germany), UTEX (USA) установлено, что хлорарахниофиты, эустигматофиты, пелагофиты, феотамниофиты и ульвофиты также имеют очень высокий уровень жизнеспособности после оттаивания, данные сопоставимы с другими водорослями и цианобактериями. Отмечено, что практически все водоросли с большим размером клеток, а также большинство нитчатых штаммов пока не могут быть успешно криоконсервированы, при этом нет фундаментальных причин, из-за которых крупные и более сложные водоросли не могут быть криоконсервированы. Таким образом, дальнейшие исследования основных механизмов повреждений при замораживании и оптимизация режимов позволят расширить количество и разнообразие таксонов водорослей, которые будут успешно криоконсервированы.
Методы криоконсервации разработаны для пресноводных микроводорослей Chlorella fusca Shihira & C. Krauss, ChloreIla emersonii Shihira & Krauss, Chlamydomonas reinhardii Gardner, Chlamydomonas nivalis (Bauer) Wille, (Morris, 1976; Morris, Clarke, 1978; Morris et al., 1979); а также морских видов Chlorella marina Butcher, Chlorella ovalis Butcher, Chlorella salina Butcher, Chlorella spaerckii Аlvik, Nannochloris (Picochlorum) atomus Butcher, Nannochloris oculate (Droop) Hibberd, Nannochloris sarniens Naumann, Nannochloris sp., Phaeodactylum tricomutum Bohlin, Platymonas suecica Kylin (Ben-Amotz, Gilboa, 1980; BenAmotz, Rosenthal, 1981). Авторы McLellan (1989) и Demirel et al. (2016), Stock et al. (2018) концентрировались на диатомовых водорослях: Stephanodiscus sp., Fragilaria crotonensis Kitton, Cylindrotheca closterium (Ehrenberg) Reimann & J. Lewin , Cyclotella meneghiniana Kütz, Opephora guenter-grassii (Witkowski & Lange-Bertalot) Sabbe & Vyverman, Pinnularia borealis Ehrenb., Seminavis robusta Danielidis & Mann, Thalassiosira weissflogii (Grunow) Fryxell & Hasle, Amphora capitellata (Kützing), Nanofrustulum shiloi (Lee, Reimer & McEnery) Round, Hallsteinsen & Paasche. Однако многие аспекты криобиологии плохо задокументированы для фитопланктонных видов. Более того, имеется ограниченная информация о криоконсервации морских микроводорослей, представляющих коммерческий интерес.
а) Хранение при низких температурах. Понижение температуры приводит к замедлению всех биохимических реакций, протекающих в организме, до уровня тем более низкого, чем ниже температура хранения. Наиболее благоприятным температурным диапазоном для хранения культур микроорганизмов в холодильниках являются температуры от –60°С до –130°С, то есть значительно более низкие температуры, чем точка эвтектики клеточных суспензий (для большинства суспензий микроорганизмов точка эвтектики находятся в диапазоне от –5°С до –15°С, однако для некоторых растворов они ниже –30°С) (Khasaeva et al., 1988; Сидякина, 1991; Ефременко и др. 2014; Iturriaga, Sullivan, 2015). Для успешной консервации различных видов микроорганизмов методами низкотемпературного хранения и криоконсервации используют предварительное подсушивание клеток на обезвоженных носителях, что способствует их безболезненному замораживанию в состояние холодного анабиоза (Белоус, Жегунов, 1987; Сидякина, 1988, 1991). Известно, что чем больше обезвожен микроорганизм, тем лучше он переносит замораживание и повторные циклы «замораживание – оттаивание». Кроме того, обычно иммобилизированные клетки микроорганизмов сохраняют жизнеспособность и биохимическую активность при воздействии экстремальных факторов, связанных с консервацией, гораздо лучше, чем свободные клетки микроорганизмов.
б) Криоконсервация ультрабыстрым способом. Данный режим консервации осуществляется путем непосредственного погружения ампул с микроорганизмами и раствором криопротектора в жидкий азот со скоростью охлаждения ~400 град/мин (Day et al., 1997, 2010). Для криоконсервации может быть использована суспензия клеток либо спор микроорганизмов, или диски 5% агара с культурой, как в растворе криопротектора, так и без него. В качестве защитных сред и криопротекторов используются как отдельные низкомолекулярные вещества (глицерин, диметилсульфоксид, сахароза и др.) (Crowe et al., 1997; Liao et al., 2002; Hincha et al., 2002; Liu, Mazur, 2003; Stock et al., 2018), так и высокомолекулярные соединения (декстран, крахмал, полиэтиленгликоль, поливинилпирролидон, агар-агар и др.) (Womersley et al., 1986; Crowe et al., 1997; Sun et al., 1998; Liao et al., 2002), а также некоторые компоненты животного происхождения (сыворотка крови, желатин, обезжиренное молоко и др.). Различают криопротекторы двух типов: проникающие и непроникающие. К проникающим относят криопротекторы, проникающие внутрь клетки. Они препятствуют формированию кристаллов льда за счет образования водородных связей с молекулами воды. Наиболее распространенные проникающие криопротекторы: глицерин, пропиленгликоль, этиленгликоль, диметилсульфоксид. К непроникающим относят криопротекторы, не проникающие внутрь клеток. Принцип их действия до конца не ясен. Предполагают, что они снижают скорость роста кристаллов и защищают клетки от осмотических перепадов. К непроникающим криопротекторам относят две группы веществ: олигосахариды (наиболее часто используют сахарозу и трегалозу) и высокомолекулярные соединения (наиболее часто используют фиколл, альбумин, поливинилпирролидон). Использование непроникающих криопротекторов в отсутствие проникающих неэффективно, то есть непроникающие криопротекторы являются дополнительными компонентами в растворах проникающих криопротекторов. В соответствии с индивидуальными особенностями микроорганизмов и условиями консервации (Joseph et al., 2000) необходимо выбирать наиболее благоприятную защитную среду для замораживания. Криопротекторы – защитные агенты, как правило, влияют на эластичность цитоплазматической мембраны, связывают внутриклеточную воду и предотвращают чрезмерное обезвоживание клеток, снижают токсическое воздействие солей электролитов и препятствуют образованию крупных кристаллов льда в клетке или в непосредственной близости от клетки (Zdenek, 2003). Известно, что введение криопротекторов и защитных сред в суспензию микроорганизмов может приводить к снижению концентрации внутриклеточных и внеклеточных электронов (Tsuru, 1973; Joseph et al., 2000), изменению структуры воды внутри и вне клеток, влияет на проницаемость клеточных мембран микроорганизмов (Crowe et al., 1997; Liao et al., 2002). Предварительный контакт клеток с криопротектором вызывает их дегидратацию, торможение активности ряда ферментов и подготавливает биологические объекты к действию низких температур, предотвращая повреждения, связанные с температурным и осмотическим шоком (Salas-Leiva, Dupré, 2011; Zheng et al., 2018). Имеются данные о взаимосвязи между скоростями охлаждения, концентрациями криопротекторов и минерализацией культуральной среды при криоконсервации морских микроводорослей Rhodomonas baltica Karsten, Isochrysis affinis galbana (Strain T-ISO) Parke, Chaetoceros gracilis Schiitt, Tetraselmis chuii Butcher, Nannochloropsis gaditana Lubian и Nannochloris atomus Butcher (Cañavate, Lubian, 1995). Бразильские исследователи (Abreu et al., 2012), для определения лучшего метода криоконсервации провели сравнительный анализ трех режимов замораживания на морских микроводорослях (Thalassiosira weissflogii; Nannochloropsis oculata и Skeletonema sp.). Их охлаждали путем прямого погружения в жидкий азот (–196°C) и с помощью двухступенчатого контролируемого режима охлаждения (предварительная обработка при –18°C и –80°C) с использованием криопротекторов. Через 10–120 дней хранения определяли жизнеспособность клеток по их способности активно расти. Результаты, полученные для T. weissflogii, показали, что этот вид хорошо сохраняется при ультранизкой температуре (–196°C) в течение 10 и 30 дней с 10% Me2SO и 5% MeOH при использовании режима контролируемого охлаждения (–80°C). Клетки N. oculata были успешно криоконсервированы путем прямого замораживания и двухстадийного контролируемого охлаждения. Образцы N. oculata показали хорошие результаты при использовании 5% Me2SO, 10% Me2SO, 5% MeOH и даже без них. Микроводоросль Skeletonema sp. не удалось сохранить с помощью криоконсервирования. Полученные результаты указывают на сложность использования единого режима замораживания для различных видов микроводорослей, поскольку необходимы дальнейшие исследования для лучшего понимания повреждений клеток при замораживании и оттаивании для каждого конкретного вида.
Для микроводорослей разработан двухстадийный режим замораживания суспензии клеток, который позволяет максимально сохранить клетки в жизнеспособном состоянии. Так, ученые коллекции ССАР еще в 1981 г. данным способом сохраняли более 300 штаммов водорослей Chlorococcales и Euglenophyceae (Morris, 1981), в настоящее время режимы замораживания разработаны для разных классов микроводорослей (табл. 2) (Poncet, Beno’ıt, 2003; Piasecki et al., 2009; Nakanishi et al., 2012; Nugroho et al., 2016).
Таблица 2. Успешная криоконсервация микроводорослей двухстадийным режимом
ТАБЛИЦА ОТКРЫВАЕТСЯ ПРИ НАЖАТИИ НА ССЫЛКУ
Table 2. Successful cryopreservation of microalgae by a two-stage regime
THE TABLE CAN BE SEEN BY CLICKING ON THE LINK
Известен способ криоконсервации, в котором первоначально проводят иммобилизацию клеток морской диатомовой водоросли Haslea ostrearia (Simonsen) в Са-альгинатный гель, затем осуществляют их пропитывание раствором 0,7 М сахарозы, используемой в качестве криопротектора, высушивают в потоке стерильного воздуха, замораживают высушенные образцы при –80°C и переносят их в среду жидкого азота с последующим хранением при температуре жидкого азота (Tanniou et al., 2012). Такой способ криоконсервации клеток, комбинирующий иммобилизацию клеток перед их криоконсервацией с двухстадийным замораживанием, между которыми еще используют и высушивание иммобилизованных клеток в криопротекторе, обеспечивает 76,9% выживание клеток. Однако культивирование полученных таким образом образцов клеток фототрофных микроорганизмов сопровождается бактериальным заражением вследствие присутствия в них сахарозы. Кроме того, к недостаткам этого способа криоконсервации относится его многостадийность и, соответственно, длительность и затратность (по времени, энергии, труду) самого процесса.
Преимущества криоконсервации перед лиофилизацией и высушиванием заключаются в неограниченном времени хранения культур, сохранении биохимической активности и генетической стабильности. Микроорганизмы, плохо переносящие лиофилизацию и высушивание, могут успешно храниться этим методом с сохранением высокого и стабильного титра жизнеспособных клеток (Crutchficld et al., 1999; Buhmann et al., 2013; Kumari et al., 2016). Прокариоты более устойчивы к ультрабыстрому замораживанию, чем эукариоты (Surek, 1998; Scardrough, Wirschell, 2016; Tessarolli et al., 2017). Следует отметить, что криоконсервация предпочтительна для сокращения трудоемкого и дорогостоящего рутинного субкультивирования. Она также может снизить риск генетического дрейфа. Тем не менее, криоконсервация как метод длительного хранения микроводорослей все еще находится в стадии разработки, потому что данный метод не может быть обобщен для всех видов микроводорослей. Виды микроводорослей, типы криопротекторов, методы замораживания и оттаивания являются наиболее важными факторами, которые следует учитывать при криоконсервации.
Иммобилизация клеток. В практике коллекционной работы хранение на разнообразных носителях используется давно и рассматривается как перспективное (Romo, Phez-Martinez, 1997; Chen, 2001, 2003; Gaudin et al., 2006; Luz, Bashan, 2008). Иммобилизированные клетки микроорганизмов обычно лучше переносят стрессы, связанные с лабораторной консервацией. Иммобилизация на разнообразных носителях – один из процессов, значительно повышающих устойчивость молекул ферментов и других белков к изменениям температуры, высушиванию и другим неблагоприятным воздействиям. Мягкая иммобилизация может создавать для отдельных клеток специфическое микроокружение – локально повышать концентрацию протонов и микробостатических метаболитов, протекторов, снижать концентрацию кислорода в клетках и т.д. Иммобилизирующий матрикс в этом случае выполняет функции капсулы или гликокаликса – структуры с реальным образом жизни и сохранением микроорганизмов в природных условиях.
В литературе имеются данные о сравнительной оценке методов длительного хранения морских водорослей и цианопрокариотов, иммобилизованных в пеностекле, полиуретане, стеклянных сферах, агаре, альгинате, на скошенных агарах и средах длительного хранения (Chen, 2001, 2003; Luz, Bashan, 2008). Морские водоросли, зафиксированные в агаре и альгинате, проявляли высокую жизнеспособность и немедленно прорастали при высеве на питательные среды. Однако использование полиуретана для длительного хранения культуры не было успешным (Chen, 2001, 2003).
Анализ коллекций Всемирной федерации культур (WFCC) в базе WDCM CCINFO (http://www.wfcc.info/ccinfo/home/) показал, что на 12.12.2019 было зарегистрировано 792 коллекций различных культивируемых организмов из 76 стран. Это самая обширная сводная база данных коллекций культур, которая включает как известные крупные коллекции, так и небольшие коллекции исследовательских и образовательных учреждений со всего мира. В базе зарегистрировано 46 коллекции, в названии которых упоминаются водоросли и цианобактерии. Кроме этого, известно еще 80 коллекций разнообразных микроорганизмов, которые также включают культуры микроводорослей и цианобактерий. В России зарегистрировано всего 30 биологических коллекций, из которых только 13 содержат в фондах штаммы водорослей (табл. 3).
Согласно базе данных WDCM CCINFO, самые распространенные способы хранения культур микроводорослей – это хранение на жидких средах или агаре методом периодического пересева культур (Ж), данный метод используется в 127 коллекциях (99% коллекций каталога, табл. 3). Примерно 56% коллекций использует только этот один способ хранения (рис. 1), остальные – одновременно несколько способов (рис. 2), например, такие как криоконсервация (К) – 33 (27%), лиофилизация (Л) – 13 (11%), L-высушивание (В) – 5 (4%), замораживание (З) – 19 (16%), иммобилизация в альгинатных бусинках (И) – 1 (0,8%), обезвоживание (О)– 1 (0,8%). Способ сохранения в состоянии ангидробиоза (обезвоживание) практически не используется. Единственная зарегистрированная в базе данных WDCM CCINFO коллекция, которая применяет этот способ – коллекция культур водорослей Киевского университета (ACKU WDCM 994) (Костиков и др., 2009). Этот метод также применяется в коллекции гидробионтов мирового океана ФИЦ ИнБЮМ, где создана подколлекция ангидробиозных культур микроводорослей (Царин, Царина, 2016).
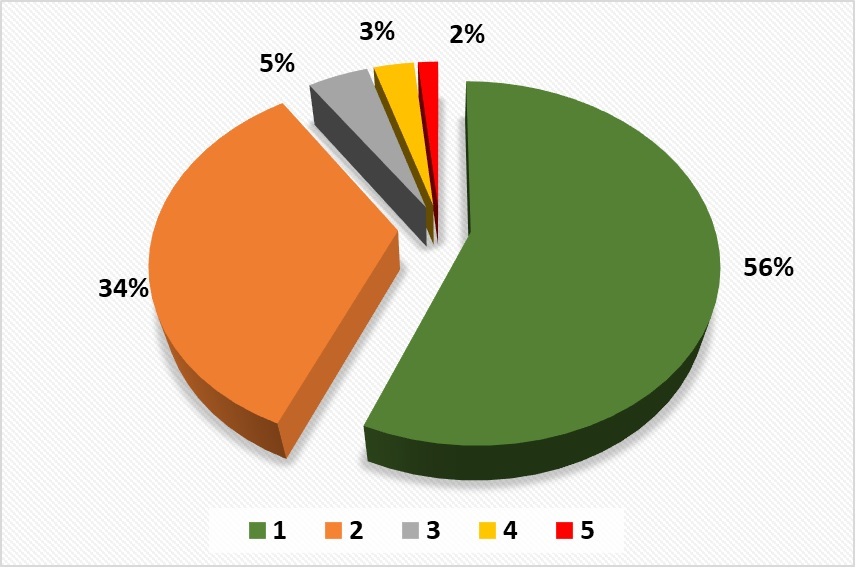
Рис.1. Количество одновременно применяемых методов хранения в мировых коллекциях микроводорослей (согласно базе данных WDCM CCINFO): 1 – один метод хранения, 2 – два метода,
3 – три метода, 4 – четыре метода, 5 – пять методов.
Fig.1. The number of simultaneously used storage methods in the world microalgae collections (according to the WDCM CCINFO database): 1 – one storage method, 2 – two methods,
3 – three methods, 4 – four methods, 5 – five methods
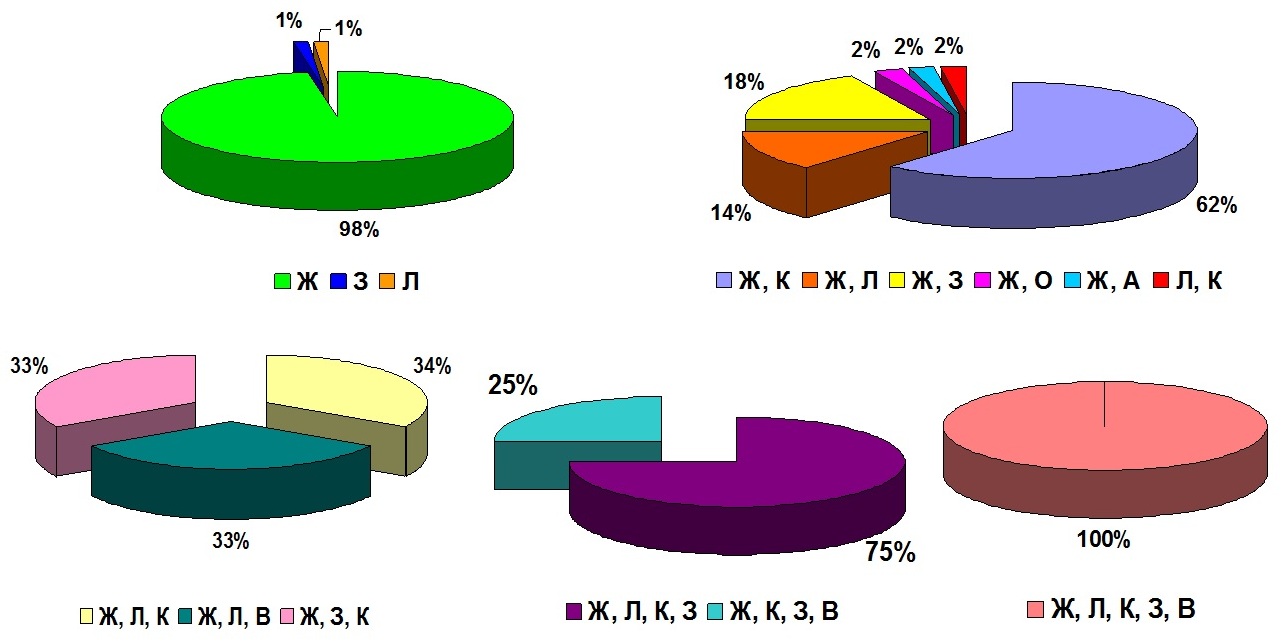
Рис. 2. Комбинации методов хранения в мировых коллекциях микроводорослей (согласно базе данных WDCM CCINFO). Ж – живые культуры (периодический пересев на жидкие и агаризованные среды), К – криоконсервация, Л – лиофилизация, В – L-высушивание, О – обезвоживание,
З – замораживание, А – альгинатные бусинки
Fig. 2. Storage methods combinations in the world microalgae collections (according to the WDCM CCINFO database). Ж – live cultures (periodic reseeding on liquid and agarized media), K – cryopreservation,
Л – lyophilization, В – L-drying, O – dehydration, З – freezing, A – alginate beads
Следует отметить, что среди крупных коллекций, в фондах которых содержится более 1 тыс. штаммов микроводорослей и цианобактерий, 74% коллекций используют комбинацию двух методов хранения: методов периодического пересева культур и криоконсервации (69%), а также периодического пересева культур и обезвоживания (5%). Около 26% крупных коллекций применяют только 1 метод – периодического пересева (21%) или лиофилизацию (5%).
В отечественных коллекциях используется метод хранения на жидких средах или агаре путем периодического пересева культур (Новаковская, Патова, 2012; Москаленко и др., 2015; Айздайчер, 2008; Кулизин и др., 2016; http://www.ippras.ru/cfc/cm/).
Таблица 3. Методы и их комбинации, используемые для длительного хранения культур водорослей и цианобактерий в коллекциях Всемирной федерации культур (WFCC) в базе WDCM CCINFO
ТАБЛИЦА ОТКРЫВАЕТСЯ ПРИ НАЖАТИИ НА ССЫЛКУ
Table 3. Methods and their combinations used for long-term storage of cultures of algae and cyanobacteria in the collections of the World Federation of Cultures (WFCC) in the WDCM CCINFO database
THE TABLE CAN BE SEEN BY CLICKING ON THE LINK
Методы сохранения микроорганизмов (бактерии, дрожжи и грибы) в обезвоженном состоянии, с помощью лиофилизации и L-высушивания широко применяют в микробиологической практике как в отечественных, так и в зарубежных коллекциях, например, RCAM WDCM 966, VIZR WDCM 760, VKM WDCM 342, VKPM WDCM 588, CBMW WDCM 986, CIAM WDCM 890, CSMS WDCM 1121, EMTC WDCM 974, IEGM WDCM 768, CIRM-Levures WDCM 788, CAIM WDCM 813, CVCM WDCM 815, YM WDCM 832, CCARM WDCM 847 и др. (http://www.wfcc.info/ccinfo/home). В альгологической практике они применяются редко.
Таким образом, проблема длительного сохранения микроводорослей актуальна и привлекает интерес ученых. Одним из возможных способов является перевод клеток в анабиотическое состояние с помощью дегидратации, однако на современном этапе развития биологических наук пока еще трудно объяснить механизмы, протекающие в клетках при их обезвоживании и регидратации. Совершенно очевидно, что изучение явления анабиоза должно быть комплексным. Исследования на клеточном уровне дают информацию о структурно-функциональных изменениях всего комплекса клеточных элементов, о путях репарации и реактивации различных обратимых перестроек и повреждений в клетках; на молекулярном уровне – о структурно-функциональных перестройках молекул нуклеиновых кислот и белков в результате их значительного обезвоживания; на популяционном уровне – об отношении отдельных организмов к анабиозу как фактору, определяющему сохранение данного вида в неблагоприятных условиях.
Автор заявляtт об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Работа подготовлена по теме государственного задания ФГБУН ИМБИ «Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса», номер гос. регистрации АААА-А18-118021350003-6».
Список литературы
- Айздайчер Н.А. Коллекция культур морских микроводорослей института биологии моря им. А.В. Жирмунского ДВО РАН // Биология моря. 2008. Т.34, №2. С. 152–155.
- Аркадьева З.А. Факторы влияющие на жизнеспособность и свойства микроорганизмов при различных методах хранения // Биол. науки. 1983. № 4. С. 93–105.
- Бекер М.Е. Обезвоживание микробной биомассы и экстрацеллюлярных метаболитов. – Рига: Зинатне, 1967. – С. 74–77.
- Бекер М.Е., Дамберг Б.Э., Рапопорт А.И. Анабиоз микроорганизмов. – Рига: Зинатне, 1981. – 252 с.
- Бекер М.Е., Лиепиньш Г.К., Кудрявцев В.И. Лиофилизация бактерий // Методы хранения коллекций культур. – М.: Наука, 1967. – С. 119–130.
- Белоус А.М., Жегунов Г.Ф. Холодный анабиоз. Роль биологических мембран // Беккер М.Е. (ред.) Торможение жизнедеятельности клеток. – Рига: Зинатне, 1987. – С. 128–137.
- Данилова М.В., Надирова И.М., Кудрявцев В.И. Лиофилизация бактерий // Методы хранения коллекционных культур. – М.: Наука, 1967. – С. 131–135.
- Ефременко Е.Н., Сенько О.В., Махлис Т.А., Мамедова Ф.Т., Холстов А.В., Варфоломеев С.Д. Способ криоконсервации клеток фототрофных микроорганизмов. // RU 2 508 397, С1. Опубликовано 27.02.2014. Бюл. №6.
- Институт биохимии и физиологии микроорганизмов Г.К. Скрябина – ИБФМ РАН Всероссийская коллекция микроорганизмов – ВКМ, URL: http://www.vkm.ru/rus/Collections.htm (дата обращения – 15.11.2018).
- Институт физиологии растений им. К.А.Тимирязева РАН. URL: http://www.ippras.ru/cfc/cm/ (дата обращения – 15.11.2018).
- Калакуцкий Л.В., Сидякина Т.М. Анабиоз и консервация микроорганизмов // Криобиология. 1988. №4. С. 1–12.
- Калакуцкий Л.В., Сидякина Т.М. Сохранение жизнеспособности микроорганизмами в природе и основные подходы к консервации лабораторных культур // Беккер М.Е. (ред.). Торможение жизнедеятельности клеток. – Рига: Зинатне, 1987. – С. 19–31.
- Кулизин П.В., Мартыненко Н.А., Гусев Е.С. Аннотированный список штаммов десмидиевых водорослей тропического региона из коллекции Института Биологии Внутренних вод им. И.Д. Папанина РАН // Труды ИБВВ РАН. 2016. Вып.76, №79. С. 69–74.
- Кузьмина Р.И. Устойчивость микроводорослей к сухой и низкотемпературной консервации и физико-химический аспект проблемы анабиоза: Автореф. дис. докт. биол. наук. – Красноярск, 1990. – 30 с.
- Колесов С.Г. Анабиоз патогенных микроорганизмов. – М.: Сельхозгиз, 1959. – С. 63–110.
- Колесов С.Г. Высушивание микроорганизмов и биопрепаратов. – М.: Сельхозгиз, 1952. – С. 43–84.
- Костиков И.Ю., Демченко Э.Н., Березовская М.А. Коллекция культур водорослей Киевского национального университета имени Тараса Шевченко. Каталог штаммов (2008 г.) // Черноморск. бот. журн. 2009. Т.5., №1. С. 37–79.
- Москаленко С.В., Темралеева А.Д., Дронова С.А., Пинский Д.Л. Альгологическая коллекция Института физико-химических и биологических проблем почвоведения РАН (ACSSI): состояние и перспективы развития // Вопросы современной альгологии. 2015. №1 (8). URL: http://algology.ru/659 (дата обращения – 5.11.2018)
- Нестеренко Т.В., Кузьмина Р.И. Реактивация микроводорослей из состояния сухого анабиоза // Вопросы управления биосинтезом низших растений. – Новосибирск: Наука, 1982. – С. 139–143.
- Новаковская И.В., Патова Е.Н. Коллекция живых штаммов микроводорослей института биологии коми НЦ УРО РАН и перспективы ее использования // Известия Коми научного центра УрО РАН, Сыктывкар. 2012. Вып.2, №10. С. 36–41.
- Похиленко В.Д., Баранов А.М., Детушев К.В. Методы длительного хранения коллекционных культур микроорганизмов и тенденции развития // Известия высших учебных заведений. Поволжский регион. Медицинские науки. 2009. № 4 (12). С. 99–121.
- Сидякина Т.М. Методы консервации микроорганизмов. Серия «Консервация генетических ресурсов». – Пущино: ОНТИ НЦБИ АН ССС, 1988. – С. 58.
- Сидякина Т.М. Консервация микроорганизмов в коллекциях культур. Серия «Консервация генетических ресурсов». – Пущино: ОНТИ НЦБИ АН ССС, 1991. – С. 81–139.
- Царин С.А., Царина Т.В. Коллекция гидробионтов мирового океана ИМБИ ИМ. А.О. Ковалевского // Морские биологические исследования: достижения и перспективы: Сб. ст. Всерос. Науч.-практич. конф. с междунар. уч., приуроч. 145-летию Севастопольской биологической станции: в 3 томах. – Севастополь: ЭКОСИ-Гидрофизика, 2016. – С. 88–91.
- Abadias M., Benabarre A., Teixido N., Usall J., Vinas I. Effect of freeze drying and protectants on viability of the biocontrol yeast Candida sake // Int. J. of Food Microbiology. 2001. V.65. Р. 173–182.
- Abreu L., Borges L., Marangoni J., Abreu P.C. Cryopreservation of some useful microalgae species for biotechnological exploitation // J. Appl. Phycol. 2012. V.24, №6. Р.1579–1588. DOI – https://doi.org/10.1007/s10811-012-9818-0.
- Ben-Amotz A., Gilboa А. Cryopreservation of Marine Unicellular Algae. 11. Induction of Freezing Tolerance // Mar. Ecol. Prog. Ser. 1980. V.2. Р. 221–224.
- Ben-Amotz A., Rosenthal H. Cryopreservation of marine unicellular algae and early life stages of fish for use in mariculture. // Spec. Publ. Europ. Maricult. 1981. Soc.6. Р. 149–162.
- Buhmann M.T., Day J.G., Kroth P.G. Post-cryopreservation viability of the benthic freshwater diatom Planothidium frequentissimun depends on light levels // Cryobiology. 2013. V.67. Р.23–29. DOI – http://dx.doi.org/10.1016/j.cryobiol.2013.04.005
- Cañavate J.P., Lubian L.M. Relationship between cooling rates, cryoprotectant concentrations and salinities in the cryopreservation of marine microalgae // Marine Biology. 1995. V.124, №2. Р. 325–334. DOI – https://doi.org/10.1007/BF00347136
- Chen Y.C. Immobilized microalgae Scenedesmus quadricanda (Chlorophyta, Chlorococcales) for long-term storage and for application for water quality control in fish culture // Aquaculture. 2001. V.195, №1–2. P. 71–80. DOI – https://doi.org/10.1016/S0044-8486(00)00540-8
- Chen Y.C. Immobilized Isochrysis galbana (Haptophyta) for long-term storage and applications for feed and water quality control in clam (Meretrix lusoria) cultures // J. Appl. Phycol. 2003. V.15, №5. P. 439–444. DOI – https://doi.org/10.1023/a:1026071714199
- Cleland J., Lam X., Kendrick B., Yang J., Yang T.H., Overcashier D., Brooks D., Hsu C., Carpenter J.F. A specific moler ratio of stabilizer to protein is required for storage stability of a lyophilized monoclonal antibody // Journ. Pharm. Sci. 2001. V.90, №3. P. 310–321. PMID: 11170024, DOI – https://doi.org/10.1002/1520-6017(200103)90:3<310::AID-JPS6>3.0.CO;2-R
- Cock J.M., Coelho S.M. Algal models in plant biology // J. Exp. Botany. 2011. V.62, №8. P. 2425–2430. DOI – https://doi.org/10.1093/jxb/err117
- Corbett L., Parker D.L. Viability of lyophilized cyanobacteria (Blue-Green Algae) // Applied and Environmental Microbiology. 1976. V.32, № 6. Р. 777–780.
- Crowe J.H., Oliver A.E., Hoekstra F.A. Crowe L.M. Stabilization of dry membranes by mixtures of hydroxyethyl starch and glucose: the role of vitrification // Cryobiology. 1997. V.35, №1. P. 20–30. DOI – https://doi.org/10.1006/cryo.1997.2020
- Crutchficld A.L.M., Diller K.R., Brand J.J. Cryopreservation of Clamydomonas reinharbtii // Eur. Journ. Phycol. 1999. V.3. P. 43–52. DOI – https://doi.org/10.1080/09670269910001736072
- Day J.G. Cryopreservation of Microalgae and Cyanobacteria // Methods Mol Biol. 2007; V.368. Р. 141–151. DOI – https://doi.org/ 10.1007/978-1-59745-362-2_10.
- Day J.G., DeVille M.M. Cryopreservation of Algae // Cryopreservation and Freeze-Drying Protocols. 1995, P. 81–89. DOI – https://doi.org/https://doi.org/10.1385/0896032965
- Day J.G, Proschold T., Friedl T., Lorenz M., Silva P.S. Conservation of microalgal type material: Approaches needed for 21st century science // TAXON. 2010. V.59, №1b. P. 3–6. http://www.jstor.org/stable/27757045
- Day J.G., Watanabe M.M., Morris G.H., Roland A., Fleck R.A., McLellan M.R. Long-term viability of preserved eukaryotic alga // J. Appl. Phycol. 1997. V.9, №2. Р. 121–127. DOI – https://doi.org/10.1023/A:1007991507314
- Demirel Z., Demirkaya C., Imamoglu E., Conk Dalay M. Diatom cultivation and lipid productivity for non-cryopreserved and cryopreserved cells // Agronomy Research. 2016. V.14, №4. Р. 1266–1273.
- Dupré Е, Salas-Leiva J-S. Cryopreservation of the microalgae Chaetoceros calcitrans (Paulsen): analysis of the effect of DMSO temperature and light regime during different equilibrium periods // Lat. Am. J. Aquat. Res. 2011. V.39, N.2. P. 271–279. DOI – https://doi.org/10.3856/vol39-issue2-fulltext-8.
- Duygu D.Y, Udoh A.U., Özer T, Erkaya I.A. The Characteristics and Importance of Microalgae Culture Collections // Süleyman Demirel Üniversitesi Eğirdir Su Ürünleri Fakültesi Dergisi. 2017. V.13, №1. Р. 80–87.
- Esteves-Ferreira А.A., Corrêa D.M., Carneiro A.P.S., Rosa R.M., Loterio R., Araújo W.L. Comparative evaluation of different preservation methods for cyanobacterial strains // J. Appl. Phycol. 2013. V.25, №4. P. 919–929. DOI – https://doi.org/10.1007/s10811-012-9927-9
- Gana N.H.T., Arguelles E.D.L.R., Monsalud R.G. Applicability of Liquid-Drying for the Preservation of Microalgal Cultures // Philipp. Scient. 2014. V.51, P. 128–138.
- Gaudin P., Lebeau T., Robert J-M. Microalgal cell immobilization for the long-term storage of the marine diatom Haslea ostrearia // J. Appl. Phycol. 2006. V.18. P. 175–184. DOI – https://doi.org/10.1007/s10811-006-9092-0
- Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. 2015. URL: http://www.algaebase.org (дата обращения: 12.12.2019).
- Hertzberg S., Jensen A. Studies of alginate – immobilized marine microalgae // Bot. Mar. 1989. V.32. Р. 267–273. DOI – https://doi.org/10.1515/botm.1989.32.4.267
- Hincha D.K., Zuther E., Hellwege E.M., Heyer AG. Specific effects of fructo- and gluco-oligosaccharides in the preservation of liposomes during drying // Glycobiology. 2002. V.12, №2. P. 103–110.
- Hohmann-Marriott M.F., Blankenship R.E. Evolution of photosynthesis // Annual review of plant biology. – 2011. V.62. P. 515–548. DOI – https://doi.org/10.1146/ annurev-arplant-042110-103811
- Holzinger A., Karsten U. Desiccation stress and tolerance in green algae: Consequences for ultrastructure, physiological, and molecular mechanisms // Frontiers in Plant Science. 2013. V.4. P. 327–345. DOI – https://doi.org/10.3389/fpls.2013.00327
- Iturriaga R., Sullivan C.V. Long-term presarvation of microalgal cells and their optical properties // Oceanography. 2015. V.3, №1. P. 2332–2632. DOI – https://doi.org/10.4172/2332-2632.1000134
- Joseph I., Panigrahi A., Chandra P.K. Tolerance of three marine microalgae to cryoprotectansts dimethyl sulfoxide, menhanol and glycerol // Indian Journ. Mar. Sci. 2000. V.29, №3. Р. 243–247.
- Joubert W.A., Britz T.J. A simplt and inexpensive method for the long-term preservation of microbial cultures // Journ. Microbiol. Methods. 1987. V.7, №2–3. P. 73–76.
- Khasaeva F.M., Sidyakina T.M., Modyanova L.V., Taptykova S.D. Survival and Biochemical Activity of Bakteria Arthrobacter crystallopoietes VKM AC – 1098 after Freeze – Druing and Cryopreservation // VI Intern. Congr. of Culture Collections (Oct. 30 – Nov. 4, 1988). Abstr. – Washington, 1988. – P. 73.
- Koh H.Y., Lee J.H., Han S.J., Park H., Lee S.G. Effect of the anti- freeze protein from the arctic yeast Leucosporidium sp. AY30 on cryopreservation of the marine diatom Phaeodactylum tricornutum. // Applied Biochemistry and Biotechnology. 2015. V.175. P. 677–686.
- Kröger М., Klemm М., Nelles М. Extraction behavior of different conditioned S. rubescens. // Energies. 2019. V.12, №7. Р. 1336–1343. DOI – https://doi.org/10.3390/en12071336
- Kumari N., Gupta M.K., Singh R.K. Open encapsulation-vitrification for cryopreservation of algae // Cryobiology. 2016. V.73, №2. P. 232–239. DOI – https://doi.org/10.1016/j.cryobiol.2016.07.005
- Liao Y.H., Brown M.B., Nazir T., Quader A., Martin G.P. Effects of sucrose and tregalose on the preservation of the native structure of spray-dried lysozyme // Pharm. Res. 2002. V.19, №12. P. 1847–1853. PMID: 12523664
- Lin L.P. Microstructure of spray-dried and freeze-dried microalgal powders // Food microstructure. 1985. V.4. №2. P. 341–348.
- Liu X.H., Mazur P. Effects of sugars on the kinetics of drying and on the survival of partially dehydrated larvae of Anopheles mosquitoes // Journ. Insect Physiol. 2003. V.49, №7. P. 685–695. PMID: 12837321
- Luz E. De-B., Bashan Y. Joint Immobilization of Plant Growth-Promoting Bacteria and Green Microalgae in Alginate Beads as an Experimental Model for Studying Plant-Bacterium Interactions // Applied and environmental microbiology. 2008. V.74, №21. P. 6797–6802. doi:10.1128/AEM.00518-08
- McGrath M.R, Daggett P-M. Dilworth S. Freeze drying of algae: Chlorophyta and Chrysophyta // Journ. Phycol. 1978. V.14, №4. Р. 521–525. DOI – https://doi.org/10.1111/j.1529-8817.1978.tb02480.x
- McLellan M.R. Cryopreservation of diatoms // Diatom Research. 1989. №4:2. Р. 301–318, DOI – https://doi.org/10.1080/0269249X.1989.9705078
- Morris G.J. The Cryopreservation of Chlorella 2. Effect of Growth Temperature on Freezing Tolerance // Arch. Microbiol., 1976. V.107. P. 309–312. DOI – https://doi.org/10.1007/BF00425345.
- Morris G.J., Clarke A. The Cryopreservation of Chlorella 4. Accumulation of Lipid as a Protective Factor // Arch. Microbiol., 1978. V.119. P. 153–156. DOI – https://doi.org/10.1007/BF00964266.
- Morris G.J., Coulson G., Clarke A. The cryopreservation of Chlamydomonas. // Cryobiology, 1979. V.16, №4. P. 401–410. DOI – https://doi.org/10.1016/0011-2240(79)90052-X.
- Morris G.J. Cryopreservation. An introduction to cryopreservation in culture collections. – Cambridge: Institute of Terrestrial Ecology. 1981. – 27 р.
- Nakanishi K., Deuchi K., Kuwano K. Cryopreservation of four valuable strains of microalgae, including viability and characteristics during 15 years of cryostorage// J.Appl.Phycol. 2012. V.24, №6. Р. 1381–1385. DOI – https://doi.org/10.1007/s10811-012-9790-8.
- Nugroho W.S.K., Do-A Kim, Kim D-W., Koo B-W., Hur Y.B., Kim H.J. Current Advances in Cryopreservation of Microalgae. // Jour. Marine Life Science. April 2016; V.1, №1. P. 70–78. http://jmls.or.kr
- Park H.K. Long-term Preservation of Bloom-forming Cyanobacteria by Cryopreservation // Algae. 2006. V.21, №1. P. 125–131.
- Piasecki В.P., Dille K.R., Brand J.J. Cryopreservation of Chlamydomonas reinhardtii: A cause of low viability at high cell density // Cryobiology. 2009. V.58. P. 103–109. DOI – https://doi.org/10.1016/j.cryobiol.2008.11.001
- Poncet J.-M., Beno’ıt V. Cryopreservation of the unicellular marine alga, Nannochloropsis oculata // Biotechnology Letters. 2003. V.25, №23. Р. 2017–2022. DOI – https://doi.org/10.1023/B:BILE00004395.04116.45
- Potts M. Desiccation tolerance of prokaryotes // Microbiol Rev. 1994. V.58, №4. P. 755–805. PMID: 7854254
- Rhodes L., Smith J., Tervit R., Roberts R., Adamson J., Adams S., Decker M. Cryopreservation of economically valuable marine micro-algae in the classes Bacillariophyceae, Chlorophyceae, Cyanophyceae, Dinophyceae, Haptophyceae, Prasinophyceae, and Rhodophyceae. // Cryobiology. 2006. V.52. P. 152–156.
- Romo S., Ph-ez-Martinez C. The use of immobilization in alginate beads for long term storage of Pseudanabaena galeata (cyanobacteria) in the laboratory // J. Phycol. 1997. V.33. P. 1073–1076. DOI – https://doi.org/10.1111/j.0022-3646.1997.01073.x.
- Sakane T. Preservation of microorganisms by L – drying // Journ. Reefing. 1982. V.57, №6. Р. 767–775.
- Salas-Leiva J.S., Dupré Е. Cryopreservation of the microalgae Chaetoceros calcitrans (Paulsen): analysis of the effect of DMSO temperature and light regime during different equilibrium periods // Lat. Am. J. Aquat. Res. 2011. V.39, №2. Р. 271–279. DOI – https://doi.org/ 10.3856/vol39-issue2-fulltext-8
- Scardrough C., Wirschell M. Comparative analysis of cryopreservation method in Chlamydomonas reinhardtii // Cryobiology. 2016. V.73. P. 291–295. DOI – https://doi.org/10.1016/j.cryobiol.2016.07.011
- Sharma V.K., Kalonia D.S. Effect of vacuum drying on protein-mannitol interactions: the physical state of mannitol and protein structure in the dried state // AAPS Pharm. Sci. Tech. 2004. V.5, №1. Р. 10. DOI – https://doi.org/10.1208/pt050110, PMID: 15198531
- Stock W., Pinsee E., Decker S.D., Sefbom J., Blommaert L., Chepurnova O., Sabbe K., Vyverman W. Expanding the toolbox for cryopreservation of marine and freshwater diatoms // Scientific reports. 2018. V.8. P. 4279–4288. DOI – https://doi.org/10.1038/s41598-018-22460-0
- Sun W.Q., Davidson P., Chan H.S. Protein stability in the amorphous carbohydrate matrix: relevance to anhydrobiosis // Biochim. Biophys. Acta. 1998. V.1425, №1. P. 245–254. PMID: 9813351, DOI – https://doi.org/10.1016/S0304-4165(98)00077-4
- Sun Q., Liu L., Wu L., Li W., Liu Q., Zhang J., Liu D., Ma J. Web resources for microbial data // Genomics, proteomics & bioinformatics. 2015. V.13, №1. P. 69–72. DOI – https://doi.org/10.1016 / j.gpb.2015.01.008
- Surek B. Meeting report : Intern. Symp. on the Cryopreservation of Algae (Austin, Texas, USA, Apr. 16–17, 1988) // Protist. 1998. V.149, №3. Р. 201–205.
- Tanniou A., Turpin V., Lebeau Th. Comparison of cryopreservation methods for the long termstorage of the marine diatom Haslea ostrearia (Simonsen) // Cryobiology. 2012. V.65, №1. P. 45–50. DOI – https://doi.org/10,1016 / j.cryobiol.2012.03.011.
- Tessarolli L.P., Day J.G., Henriques A.A. Vieira1 Establishment of a cryopreserved biobank for the Culture Collection of Freshwater Microalgae (CCMA-UFSCar), São Paulo, Brazil // Biota Neotropica. 2017. V.17., №2. e20160299. DOI – https://doi.org/10.1590/1676-0611-BN-2016-0299
- Tsuru S. Preservation of marine and fresh water aiga by means of freezing and freeze-drying // Cryobiology. 1973. V.10, №5. Р. 445–452. DOI – https://doi.org/10.1016/0011-2240(73)90074-6
- Viera L.I., Alonso-Romanowski S., Borovyagin V., Feliz M.R., Disalvo E.A. Properties of gel phase lipid-trehalose bilayers upon rehydration // Biochim. Biophys. Acta. 1993. V.1145, №1. Р. 157–167. PMID: 8422407
- Wessman P., Håkansson S., Leifer K., Rubino S. Formulations for Freeze-drying of Bacteria and Their Influence on Cell Survival // J Vis Exp. 2013. V.78. P. 4058.
- Wijffels R.H., Kruse O., Hellingwerf K.J. Potential of industrial biotechnology with cyanobacteria and eukaryotic microalgae // Current Opinion in Biotechnology. 2013. V.24, №3. P. 405–413. DOI – https://doi.org/10.1016/j.copbio.2013.04.004
- Womersley C., Ustet P.S., Rudolph A.S., .Crowe J.H. Inhibition of dehydration-induced fusion between liposomal membranes by carbohydrates as measured by fluorescence energy transfer // Cryobiology. 1986. V.23, №3. P. 245–255. DOI – https://doi.org/10.1016/0011-2240(86)90050-7
- World Federation for Culture Collection. URL: http://www.wfcc.info (дата обращения: 22.10.2018)
- Wu L., Sun Q., Desmeth P., Sugawara H., Xu Z., McCluskey K., Smith D., Alexander V., Lima N., Ohkuma M., Robert V., Zhou Y., Li J., Fan G., Ingsriswang S., Ozerskaya S., Ma J. World data centre for microorganisms: an information infrastructure to explore and utilize preserved microbial strains worldwide // Nucleic Acids Research. 2017. V.45. P. 611–618. DOI – https://doi.org/10.1093/nar/gkw903
- Zdenek H. Protectants used in the cryopreservation of microorganisms. // Cryobiology. 2003. V.46, №3. P. 205–229. DOI: 10.1016/S0011-2240(03)00046-4.
- Zheng L., Lu Z., Zhang Q., Li T., Song L.A. fluorescence ratio-based method to determine microalgal viability and its application to rapid optimization of cryopreservation // Cryobiology. 2018. V.81. P.27–33. DOI – https://doi.org/10.1016/j.cryobiol.2018.02.014
Статья поступила в редакцию 1.11.2018
Статья поступила после доработки 16.12.2019
Статья принята к публикации 26.12.2019
Об авторах
Харчук Ирина Алексеевна - Kharchuk Irina A.
кандидат биологических наук
старший научный сотрудник, ФИЦ «Институт биологии южных морей имени А.О. Ковалевского РАН», Севастополь, Россия (FIC «Kovalevsky Institute of Biology of the Southern Seas RAS», Sevastopol, Russia), Отдел биотехнологий и фиторесурсов
seaferm@yandex.ru
Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФГБУН ИМБИ; тел. (869)-2550795.
ССЫЛКА НА СТАТЬЮ:
Харчук И.А. Обзор методов длительного хранения культур микроводорослей и цианобактерий, используемых в коллекциях Всемирной федерации культур (WFCC) в базе WDCM CCINFO // Вопросы современной альгологии. 2019. № 3 (21). С. 1–27. URL: http://algology.ru/1563
DOI - https://doi.org/10.33624/2311-0147-2019-3(21)-1-27
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
Адрес - info@algology.ru
При перепечатке ссылка на сайт обязательна
.
The review of methods of the long-term storage of microalgae and cyanobacteria cultures used in collections of the world federation of cultures (WFCC) in WDCM CCINFO base
Irina A. Kharchuk
FIC «Kovalevsky Institute of Biology of the Southern Seas RAS» (Sevastopol, Russia)
Information on methods of the long-term storage of microalgas and cyanobacteria is represented in the database of world collections of alive cultures WDCM CCINFO. Summary of each method is given. Data on combinations of ways of the long-term storage of the microalgas and cyanobacteria used in the largest world collections are provided.
Keywords: microalgae; cyanobacteria; methods of storage; WDCM CCINFO; freeze-drying; cryopreservation; L-drying; dehydration; freezing; immobilization.
References
- Abadias M., Benabarre A., Teixido N., Usall J., Vinas I. Effect of freeze drying and protectants on viability of the biocontrol yeast Candida sake. International Journal of Food Microbiology. 2001. V.65, Р. 173–182.
- Abreu L., Borges L., Marangoni J., Abreu P.C. Cryopreservation of some useful microalgae species for biotechnological exploitation. J. Appl. Phycol. 2012. V.24., №6. Р. 1579–1588. DOI – https://doi.org/10.1007/s10811-012-9818-0.
- Ajzdajcher N.A. Kollektsiya kul'tur morskih mikrovodoroslej instituta biologii morya im. A.V. Zhirmunskogo DVO RAN [Collection of cultures of marine microalgae Institute of Marine Biology A.V. Zhirmunsky FEB RAS]. Biologiya morya. 2008. T.34, №2. P. 152–155.
- Arkad'eva Z.A. Faktory vliyayuschie na zhiznesposobnost' i svojstva mikroorganizmov pri razlichnyh metodah hraneniya [Factors affecting the viability and properties of microorganisms in various storage methods]. Biol. nauki. 1983. №4. P. 93–105.
- Beker M.E. Obezvozhivanie mikrobnoj biomassy i ehkstratsellyulyarnyh metabolitov [Dehydration of microbial biomass and extracellular metabolites]. Zinatne, Riga, 1967. P. 74–77.
- Beker M.E., Damberg B.E., Rapoport A.I. Anabioz mikroorganizmov [Microorganism Anabiosis]. Zinatne, Riga, 1981. 252 p.
- Beker M.E., Liepin'sh G.K., Kudryavtsev V.I. Liofilizatsiya bakterij [Lyophilization of bacteria]. In: Metody hraneniya kollektsij kul'tur [Methods for storing crop collections]. Nauka, Moscow, 1967. P. 119–130.
- Belous A.M., Zhegunov G.F. Holodnyj anabioz. Rol' biologicheskih membran [Cold suspended animation. The role of biological membranes]. In: Bekker M.E. (Ed.). Tormozhenie zhiznedeyatel'nosti kletok [Inhibition of cell activity]. Zinatne, Riga, 1987. P. 128–137.
- Ben-Amotz A., Gilboa А. Cryopreservation of Marine Unicellular Algae. Induction of Freezing Tolerance. Mar. Ecol. Prog. Ser. 1980, V.2. Р. 221–224.
- Ben-Amotz A., Rosenthal H. Cryopreservation of marine unicellular algae and early life stages of fish for use in mariculture. Spec. Publ. Europ. Maricult. 1981. Soc. 6. Р. 149–162.
- Buhmann M.T., Day J.G., Kroth P.G. Post-cryopreservation viability of the benthic freshwater diatom Planothidium frequentissimun depends on light levels. Cryobiology. 2013. V.67. Р. 23–29. DOI – https://doi.org/10.1016/j.cryobiol.2013.04.005
- Cañavate J. P., Lubian L. M. Relationship between cooling rates, cryoprotectant concentrations and salinities in the cryopreservation of marine microalgae. Marine Biology. 1995. V.124, №2. Р. 325–334. DOI – https://doi.org/10.1007/BF00347136
- Chen Y.C. Immobilized microalgae Scenedesmus quadricanda (Chlorophyta, Chlorococcales) for long-term storage and for application for water quality control in fish culture. Aquaculture. 2001. V.195, №1–2. P. 71–80. DOI – https://doi.org/10.1016/S0044-8486(00)00540-8
- Chen Y.C. Immobilized Isochrysis galbana (Haptophyta) for long-term storage and applications for feed and water quality control in clam (Meretrix lusoria) cultures. J. of Applied Phycology. 2003. V.15, №5. P. 439–444. DOI – https://doi.org/10.1023/a:1026071714199
- Cleland J., Lam X., Kendrick B., Yang J., Yang T.H., Overcashier D., Brooks D., Hsu C., Carpenter J.F. A specific moler ratio of stabilizer to protein is required for storage stability of a lyophilized monoclonal antibody. Journ. Pharm. Sci. 2001. V.90, №3. P. 310–321. PMID: 11170024, DOI – https://doi.org/10.1002/1520-6017(200103)90:3<310::AID-JPS6>3.0.CO;2-R
- Cock J.M., Coelho S.M. Algal models in plant biology. Journal of Experimental Botany. 2011. V.62, №8. P. 2425–2430. DOI – https://doi.org/10.1093/jxb/err117
- Corbett L., Parker D.L. Viability of lyophilized cyanobacteria (Blue-Green Algae). Applied and Environmental Microbiology. 1976. V.32, №6. Р. 777–780.
- Crowe J.H., Oliver A.E., Hoekstra F.A. Crowe L.M. Stabilization of dry membranes by mixtures of hydroxyethyl starch and glucose: the role of vitrification. Cryobiology. 1997. V.35, №1. P. 20–30. DOI – https://doi.org/10.1006/cryo.1997.2020.
- Crutchficld A.L.M., Diller K.R., Brand J.J. Cryopreservation of Clamydomonas reinharbtii. Eur. Journ. Phycol. 1999. V.3. P. 43–52. DOI – https://doi.org/10.1080/09670269910001736072.
- Danilova M.V., Nadirova I.M., Kudryavtsev V. I. Liofilizatsiya bakterij [Lyophilization of bacteria]. In: Metody hraneniya kollektsionnyh kul'tur [Methods for storing crop collections]. Nauka, Moscow, 1967. P. 131–135.
- Day J.G. Cryopreservation of Microalgae and Cyanobacteria. Methods Mol Biol. 2007; V.368. Р. 141–151. DOI – https://doi.org/10.1007/978-1-59745-362-2_10.
- Day J.G., DeVille M.M. Cryopreservation of Algae. Cryopreservation and Freeze-Drying Protocols. 1995. P. 81-89. DOI – https://doi.org/10.1385/0896032965
- Day J.G, Proschold T., Friedl T., Lorenz M., Silva P.S. Conservation of microalgal type material: Approaches needed for 21st century science. TAXON. 2010. V.59, №1b. P. 3–6. http://www.jstor.org/stable/27757045
- Day J.G., Watanabe M.M., Morris G.H., Roland A., Fleck R.A., McLellan M.R. Long-term viability of preserved eukaryotic alga. Journ. Appl. Phycol. 1997. V.9, №2. Р. 121–127. DOI – https://doi.org/10.1023/A:1007991507314
- Demirel Z., Demirkaya C., Imamoglu E., Conk Dalay M. Diatom cultivation and lipid productivity for non-cryopreserved and cryopreserved cells. Agronomy Research. 2016. V.14, №4. Р. 1266–1273.
- Dupré Е, Salas-Leiva J-S. Cryopreservation of the microalgae Chaetoceros calcitrans (Paulsen): analysis of the effect of DMSO temperature and light regime during different equilibrium periods. Lat. Am. J. Aquat. Res. 2011. V.39, N.2. P. 271–279. DOI – https://doi.org/ 10.3856/vol39-issue2-fulltext-8.
- Duygu D.Y, Udoh A.U., Özer T, Erkaya I.A. The Characteristics and Importance of Microalgae Culture Collections. Süleyman Demirel Üniversitesi Eğirdir Su Ürünleri Fakültesi Dergisi. 2017. V. 13, №1. Р. 80–87.
- Efremenko E.N., Sen'ko O.V., Mahlis T.A., Mamedova F.T., Holstov A.V., Varfolomeev S.D. Sposob kriokonservatsii kletok fototrofnyh mikroorganizmov [Method for cryopreservation of phototrophic microorganism cells]. RU 2 508 397, S1. Opublikovano 27.02.2014. Byul. №6.
- Esteves-Ferreira А.A., Corrêa D.M., Carneiro A.P.S., Rosa R.M., Loterio R., Araújo W.L. Comparative evaluation of different preservation methods for cyanobacterial strains. Journal of Applied Phycology. 2013. V.25, №4. P. 919–929. DOI – https://doi.org/10.1007/s10811-012-9927-9
- Gana N.H.T,. Arguelles E.D.L.R, Monsalud R.G. Applicability of Liquid-Drying for the Preservation of Microalgal Cultures. Philipp. Scient. 2014. V.51. P. 128–138.
- Gaudin P., Lebeau T., Robert J-M. Microalgal cell immobilization for the long-term storage of the marine diatom Haslea ostrearia. J. Appl. Phycol. 2006. V.18. P. 175–184. DOI – https://doi.org/10.1007/s10811-006-9092-0
- Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. 2015. URL: http://www.algaebase.org (date – 12.12.2019).
- Hertzberg S., Jensen A. Studies of alginate – immobilized marine microalgae. Bot. Mar. 1989. V.32. Р. 267–273. DOI – https://doi.org/10.1515/botm.1989.32.4.267
- Hincha D.K., Zuther E., Hellwege E.M., Heyer AG. Specific effects of fructo- and gluco-oligosaccharides in the preservation of liposomes during drying. Glycobiology. 2002. V.12, №2. P. 103–110.
- Hohmann-Marriott M.F., Blankenship R.E. Evolution of photosynthesis. Annual review of plant biology. 2011. V.62. P. 515–548. DOI – https://doi.org/10.1146/annurev-arplant-042110-103811
- Holzinger A., Karsten U. Desiccation stress and tolerance in green algae: Consequences for ultrastructure, physiological, and molecular mechanisms. Frontiers in Plant Science. 2013. V.4. P. 327–345. DOI – https://doi.org/10.3389/fpls.2013.00327
- Institut biohimii i fiziologii mikroorganizmov G.K Skryabina. IBFM RAN Vserossijskaya kollektsiya mikroorganizmov [Institute of Biochemistry and Physiology of Microorganisms G.K. Scriabin – IBPM RAS All-Russian Collection of Microorganisms]. VKM, URL: http://www.vkm.ru/rus/Collections.htm (date – 15.11.2018).
- Institut fiziologii rastenij im. K.A.Timiryazeva RAN [Institute of Plant Physiology K.A. Timiryazev RAS]. URL: http://www.ippras.ru/cfc/cm/ (data obrascheniya – 15.11.2018).
- Iturriaga R., Sullivan C.V. Long-term presarvation of microalgal cells and their optical properties. Oceanography. 2015. V.3, №1. P. 2332–2632. DOI – https://doi.org/10.4172/2332-2632.1000134
- Joseph I., Panigrahi A., Chandra P.K. Tolerance of three marine microalgae to cryoprotectansts dimethyl sulfoxide, menhanol and glycerol. Indian Journ. Mar. Sci. 2000. V.29, №3. Р. 243–247.
- Joubert W.A., Britz T.J. A simplt and inexpensive method for the long-term preservation of microbial cultures. Journ. Microbiol. Methods. 1987. V.7, №2–3. P. 73–76.
- Kalakutskij L.V., Sidyakina T.M. Anabioz i konservatsiya mikroorganizmov [Anabiosis and preservation of microorganisms]. Kriobiologiya. 1988. №4. P. 1–12.
- Kalakutskij L.V., Sidyakina T.M. Sohranenie zhiznesposobnosti mikroorganizmami v prirode i osnovnye podhody k konservatsii laboratornyh kul'tur [Preservation of viability by microorganisms in nature and the main approaches to the conservation of laboratory cultures]. Bekker M.E. (Ed.). Tormozhenie zhiznedeyatel'nosti kletok [Inhibition of cell activity]. Zinatne, Riga, 1987. P. 19–31.
- Khasaeva F.M., Sidyakina T.M., Modyanova L.V., Taptykova S.D. Survival and Biochemical Activity of Bakteria Arthrobacter crystallopoietes VKM AC – 1098 after Freeze – Druing and Cryopreservation. VI Intern. Congr. of Culture Collections (Oct. 30 – Nov. 4, 1988). Abstr. Washington, 1988. P. 73.
- Koh H.Y., Lee J.H., Han S.J., Park H., Lee S.G. Effect of the anti- freeze protein from the arctic yeast Leucosporidium sp. AY30 on cryopreservation of the marine diatom Phaeodactylum tricornutum. Applied Biochemistry and Biotechnology. 2015. V.175, P. 677–686.
- Kolesov S.G. Anabioz patogennyh mikroorganizmov [Pathogen anabiosis]. Sel'hozgiz, Moscow, 1959. P. 63–110.
- Kolesov S.G. Vysushivanie mikroorganizmov i biopreparatov [Drying of microorganisms and biological products]. Sel'hozgiz, Moscow, 1952. P. 43–84.
- Kostikov I.YU., Demchenko EH.N., Berezovskaya M.A. Kollektsiya kul'tur vodoroslej Kievskogo natsional'nogo universiteta imeni Tarasa SHevchenko. Katalog shtammov (2008 g.) [Collection of algae cultures of Taras Shevchenko National University of Kyiv. The strain catalog (2008)]. Chernomorsk. bot. zhurn. 2009. T.5., №1. P. 37–79.
- Kröger М., Klemm М., Nelles М. Extraction behavior of different conditioned S. rubescens. Energies. 2019. V. 12, №7. Р. 1336–1343. DOI – https://doi.org/10.3390/en12071336
- Kulizin P.V., Martynenko N.A., Gusev E.S. Annotirovannyj spisok shtammov desmidievyh vodoroslej tropicheskogo regiona iz kollektsii Instituta Biologii Vnutrennih vod im. I.D. Papanina RAN [An annotated list of strains of desmidium algae in the tropical region from the collection of the Institute of Inland Water Biology named after I.D. Papanin RAS]. Trudy IBVV RAN. 2016. V.76, №79. P. 69–74.
- Kumari N., Gupta M.K., Singh R.K. Open encapsulation-vitrification for cryopreservation of algae. Cryobiology. 2016. V.73, №2. P. 232–239. DOI – https://doi.org/10.1016/j.cryobiol.2016.07.005
- Kuz'mina R.I. Ustojchivost' mikrovodoroslej k suhoj i nizkotemperaturnoj konservatsii i fiziko-himicheskij aspekt problemy anabioza [Resistance of microalgae to dry and low-temperature conservation and the physicochemical aspect of the problem of suspended animation]: PhD Dissertation abstract. Krasnoyarsk, 1990. 30 p.
- Liao Y.H., Brown M.B., Nazir T., Quader A., Martin G.P. Effects of sucrose and tregalose on the preservation of the native structure of spray-dried lysozyme. Pharm. Res. 2002. V.19, №12. P. 1847–1853. PMID: 12523664
- Lin L.P. Microstructure of spray-dried and freeze-dried microalgal powders. Food microstructure. 1985. V.4, №2. P. 341–348.
- Liu X.H., Mazur P. Effects of sugars on the kinetics of drying and on the survival of partially dehydrated larvae of Anopheles mosquitoes. Journ. Insect Physiol. 2003. V.49, №7. P. 685–695. PMID: 12837321
- Luz E. De-B.., Bashan Y. Joint Immobilization of Plant Growth-Promoting Bacteria and Green Microalgae in Alginate Beads as an Experimental Model for Studying Plant-Bacterium Interactions. Applied and environmental microbiology. 2008. V.74, №21. P. 6797–6802. DOI – https://doi.org/10.1128/AEM.00518-08
- McGrath M.R, Daggett P-M. Dilworth S. Freeze drying of algae: Chlorophyta and Chrysophyta. Journ. Phycol. 1978. V.14, №4. Р. 521–525. DOI – https://doi.org/10.1111/j.1529-8817.1978.tb02480.x
- McLellan M. R. Cryopreservation of diatoms. Diatom Research. 1989. №4:2. Р. 301–318, DOI: 10.1080/0269249X.1989.9705078
- Morris G.J. The Cryopreservation of Chlorella 2. Effect of Growth Temperature on Freezing Tolerance. Arch. Microbiol. 1976. V.107. P. 309–312. DOI – https://doi.org/10.1007/BF00425345.
- Morris G.J., Clarke A. The Cryopreservation of Chlorella 4. Accumulation of Lipid as a Protective Factor. Arch. Microbiol. 1978. V.119. P. 153–156. DOI – https://doi.org/10.1007/BF00964266.
- Morris G.J., Coulson G., Clarke A. The cryopreservation of Chlamydomonas. Cryobiology. 1979. V.16, №4. P. 401–410. DOI – https://doi.org/10.1016/0011-2240(79)90052-X.
- Morris G.J. Cryopreservation. An introduction to cryopreservation in culture collections. Institute of Terrestrial Ecology, Cambridge, 1981. 27 р.
- Moskalenko S.V., Temraleeva A.D., Dronova S.A., Pinskij D.L. Algal Collection of Soil Science Institute (ACSSI): current state and development trends. Voprosy sovremennoj al'gologii [Issues of modern algology]. 2015. №1(8). URL: http://algology.ru/659 (date – 5.11.2018)
- Nakanishi K., Deuchi K., Kuwano K. Cryopreservation of four valuable strains of microalgae, including viability and characteristics during 15 years of cryostorage. J. Appl.Phycol. 2012. V.24, №6. Р. 1381–1385. DOI – https://doi.org/10.1007/s10811-012-9790-8.
- Nesterenko T.V., Kuz'mina R.I. Reaktivatsiya mikrovodoroslej iz sostoyaniya suhogo anabioza // Voprosy upravleniya biosintezom nizshih rastenij [Reactivation of microalgae from the state of dry suspended animation]. Nauka, Novosibirsk, 1982. P. 139–143.
- Novakovskaya I.V., Patova E.N. Kollektsiya zhivyh shtammov mikrovodoroslej instituta biologii komi NTS URO RAN i perspektivy ee ispol'zovaniya [Collection of living microalgae strains of the Institute of Biology of the Komi Scientific Center, Ural Branch of the Russian Academy of Sciences and prospects for its use]. Izvestiya Komi nauchnogo tsentra UrO RAN, Syktyvkar. 2012. V.2, №10. P. 36–41.
- Nugroho W.S.K., Do-A Kim1, Kim D-W., Koo1 B-W., Hur Y. B., Kim H. J. Current Advances in Cryopreservation of Microalgae. Journal of Marine Life Science. 2016; V.1, №1. P. 70–78. http://jmls.or.kr
- Park H.K. Long-term Preservation of Bloom-forming Cyanobacteria by Cryopreservation. Algae. 2006. V.21, № 1. P. 125–131.
- Piasecki В.P., Dille K.R., Brand J.J. Cryopreservation of Chlamydomonas reinhardtii: A cause of low viability at high cell density. Cryobiology. 2009. V.58. P. 103–109. DOI – https://doi.org/10.1016/j.cryobiol.2008.11.001
- Pohilenko V.D., Baranov A.M., Detushev K.V. Metody dlitel'nogo hraneniya kollektsionnyh kul'tur mikroorganizmov i tendentsii razvitiya [Methods of long-term storage of collection cultures of microorganisms and development trends]. Izvestiya vysshih uchebnyh zavedenij. Povolzhskij region. Meditsinskie nauki. 2009. №4 (12). P. 99–121.
- Poncet J.-M., Beno’ıt V. Cryopreservation of the unicellular marine alga, Nannochloropsis oculata. Biotechnology Letters. 2003. V.25, №23. Р. 2017–2022. DOI – https://doi.org/10.1023/B:BILE00004395.04116.45
- Potts M. Desiccation tolerance of prokaryotes. Microbiol Rev. 1994. V.58, №4. P. 755–805. PMID: 7854254
- Rhodes L., Smith J., Tervit R., Roberts R., Adamson J., Adams S., Decker M. Cryopreservation of economically valuable marine micro-algae in the classes Bacillariophyceae, Chlorophyceae, Cyanophyceae, Dinophyceae, Haptophyceae, Prasinophyceae, and Rhodophyceae. Cryobiology. 2006. V.52. P. 152–156.
- Romo S., Ph-ez-Martinez C. The use of immobilization in alginate beads for long term storage of Pseudanabaena galeata (cyanobacteria) in the laboratory. J. Phycol. 1997. V.33. P. 1073–1076. DOI – https://doi.org/10.1111/j.0022-3646.1997.01073.x.
- Sakane T. Preservation of microorganisms by L–drying. Journ. Reefing. 1982. V.57, №6. Р. 767–775.
- Salas-Leiva J.S., Dupré Е. Cryopreservation of the microalgae Chaetoceros calcitrans (Paulsen): analysis of the effect of DMSO temperature and light regime during different equilibrium periods. Lat. Am. J. Aquat. Res. 2011. V.39, №2. Р. 271–279. DOI – https://doi.org/10.3856/vol39-issue2-fulltext-8
- Scardrough C., Wirschell, M. Comparative analysis of cryopreservation method in Chlamydomonas reinhardtii. Cryobiology. 2016. V.73. P. 291–295. DOI – https://doi.org/10.1016/j.cryobiol.2016.07.011
- Sharma V.K.. Kalonia D.S. Effect of vacuum drying on protein-mannitol interactions: the physical state of mannitol and protein structure in the dried state. AAPS Pharm. Sci. Tech. 2004. V.5, №1. Р. 10. DOI – https://doi.org/10.1208/pt050110, PMID: 15198531
- Sidyakina T.M. Konservatsiya mikroorganizmov v kollektsiyah kul'tur [Preservation of microorganisms in crop collections]. In: Seriya «Konservatsiya geneticheskih resursov» [Series “Conservation of genetic resources”]. ONTI NTSBI AN SSS, Puschino, 1991. P. 81–139.
- Sidyakina T.M. Metody konservatsii mikroorganizmov [Microorganism Preservation Methods]. In: Seriya «Konservatsiya geneticheskih resursov» [Series “Conservation of genetic resources”]. ONTI NTSBI AN SSS, Puschino, 1988. P. 58.
- Stock W., Pinsee E., Decker S.D., Sefbom J., Blommaert L., Chepurnova O., Sabbe K., Vyverman W. Expanding the toolbox for cryopreservation of marine and freshwater diatoms. Scientific reports. 2018. V.8. P. 4279–4288. DOI – https://doi.org/10.1038/s41598-018-22460-0
- Sun W.Q., Davidson P., Chan H.S. Protein stability in the amorphous carbohydrate matrix: relevance to anhydrobiosis. Biochim. Biophys. Acta. 1998. V.1425, №1. P. 245–254. PMID: 9813351, DOI – https://doi.org/10.1016/S0304-4165(98)00077-4
- Sun Q., Liu L., Wu L., Li W., Liu Q., Zhang J., Liu D., Ma J. Web resources for microbial data. Genomics, proteomics & bioinformatics. 2015. V.13, №1. P. 69–72. DOI – https://doi.org/10.1016 / j.gpb.2015.01.008
- Surek B. Meeting report : Intern. Symp. on the Cryopreservation of Algae (Austin, Texas, USA, Apr. 16–17, 1988). Protist. 1998. V.149, №3. Р. 201–205.
- Tanniou A., Turpin V., Lebeau Th. Comparison of cryopreservation methods for the long termstorage of the marine diatom Haslea ostrearia (Simonsen). Cryobiology. 2012. V.65, №1. P. 45–50. DOI – https://doi.org/10.1016 / j.cryobiol.2012.03.011.
- Tessarolli L.P., Day J.G., Henriques A.A. Vieira1 Establishment of a cryopreserved biobank for the Culture Collection of Freshwater Microalgae (CCMA-UFSCar), São Paulo, Brazil. Biota Neotropica. 2017. V.17, №2. e20160299. DOI - http://dx.doi.org/10.1590/1676-0611-BN-2016-0299
- Tsarin S.A., Tsarina T.V. Kollektsiya gidrobiontov mirovogo okeana IMBI IM. A.O. Kovalevskogo [A.O. Kovalevsky IMBI Collection of hydrobionts of the oceans]. Abstract title. Morskie Biologicheskie Issledovaniya: dostizheniya I Perspektivy [Marine biological research: achievements and prospects]. Vseros. Nauch.-praktich. konf. s mezhdunar. uch., priuroch. 145-letiyu Sevastopol'skoj biologicheskoj stantsii (Sevastopol, 2016). EHKOSI-Gidrofizika, Sevastopol, 2016. P. 88–91.
- Tsuru S. Preservation of marine and fresh water aiga by means of freezing and freeze-drying. Cryobiology. 1973. V.10, №5. Р. 445–452.DOI – https://doi.org/10.1016/0011-2240(73)90074-6
- Viera L.I., Alonso-Romanowski S., Borovyagin V., Feliz M.R., Disalvo E.A. Properties of gel phase lipid-trehalose bilayers upon rehydration. Biochim. Biophys. Acta. 1993. V.1145, №1. Р. 157–167. PMID: 8422407
- Wessman P., Håkansson S., Leifer K., Rubino S. Formulations for Freeze-drying of Bacteria and Their Influence on Cell Survival. J. Vis. Exp. 2013. V.78. P. 4058.
- Wijffels R.H., Kruse O., Hellingwerf K.J. Potential of industrial biotechnology with cyanobacteria and eukaryotic microalgae. Current Opinion in Biotechnology. 2013. V.24, №3. P. 405–413. DOI – https://doi.org/10.1016/j.copbio.2013.04.004
- Womersley C., Ustet P.S., Rudolph A.S., .Crowe J.H. Inhibition of dehydration-induced fusion between liposomal membranes by carbohydrates as measured by fluorescence energy transfer. Cryobiology. 1986. V.23, №3. P. 245–255. DOI – https://doi.org/10.1016/0011-2240(86)90050-7
- World Federation for Culture Collection. URL: http://www.wfcc.info (date – 22.10.2018)
- Wu L., Sun Q., Desmeth P., Sugawara H., Xu Z., McCluskey K., Smith D., Alexander V., Lima N., Ohkuma M., Robert V., Zhou Y., Li J., Fan G., Ingsriswang S., Ozerskaya S., Ma J. World data centre for microorganisms: an information infrastructure to explore and utilize preserved microbial strains worldwide. Nucleic Acids Research. 2017. V.45. P. 611–618. DOI – https://doi.org/10.1093/nar/gkw903
- Zdenek H. Protectants used in the cryopreservation of microorganisms. Cryobiology. 2003. V.46, №3. P. 205–229. DOI – https://doi.org/10.1016/S0011-2240(03)00046-4.
- Zheng L., Lu Z., Zhang Q., Li T., Song L. A fluorescence ratio-based method to determine microalgal viability and its application to rapid optimization of cryopreservation. Cryobiology. 2018. V.81. P. 27–33. DOI – https://doi.org/10.1016/j.cryobiol.2018.02.014
Author
Kharchuk Irina A.
ORCID – https://orcid.org/0000-0002-5771-2143
FIC «Kovalevsky Institute of Biology of the Southern Seas RAS», Sevastopol, Russia
seaferm@yandex.ru
ARTICLE LINK:
Kharchuk I.A. The review of methods of the long-term storage of microalgae and cyanobacteria cultures used in collections of the world federation of cultures (WFCC) in WDCM CCINFO base. Voprosy sovremennoi algologii (Issues of modern algology). 2019. № 3 (21). P. 1–27. URL: http://algology.ru/1563
DOI – https://doi.org/10.33624/2311-0147-2019-1(19)-1-27
Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free.
Address - info@algology.ru
When reprinting a link to the site is required
На ГЛАВНУЮ
Карта сайта
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
 |
|




