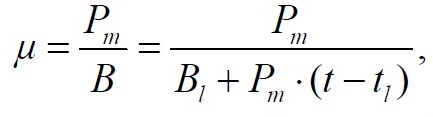|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VI Сабининские чтения 1 ноября - 15 декабря 2017 г. Репродуктивная активность клеток Dunaliella viridis Teod. в накопительной культуре при непрерывном освещении и свето-темновых циклах
Меметшаева О.А., Боровков А.Б. Olga A. Memetshaeva, Andrey B. Borovkov
Институт морских биологических исследований имени А.О. Ковалевского (Севастополь, Россия)
УДК 582.263:581.1
Экспериментальное исследование показало, что при свето-темновом режиме максимальная продуктивность по численности клеток оказалась в 1,6 раза выше, чем при постоянном освещении. Определено, что максимальный процент клеток, находящихся в репродуктивной фазе на линейном участке, при непрерывном освещении составил 25% и 33% – при свето-темновом режиме, что в 1,3 раза выше. Ключевые слова: Dunaliella viridis; плотность; численность; деление; накопительная культура; непрерывное освещение; свето-темновой режим.
Введение Dunaliella viridis Teod. – широко распространенный, легко культивируемый вид, обитающий в морях и соленых озерах. Размеры клеток, в среднем, составляют 9–12 х 6–12 мкм (Масюк и др., 2007). Клетки монадной структуры, эллипсоидной, яйцевидной или грушевидной формы, с двумя жгутиками на апикальном конце клетки. Для Dunaliella характерны вегетативный, бесполый и половой тип размножения, первый является преобладающим, происходит преимущественно в темноте (Лось, 1990; Десницкий, 1988) путем поперечного деления клеток. Отсутствие целлюлозной и пектиновой оболочки и наличие тонкой бесцветной протоплазматической мембраны позволяет рассмотреть органеллы клетки при цитокинезе, что делает микроводоросль хорошим объектом для исследования. Как было показано ранее (Комаристая и др., 1997), ответная реакция биологических систем на разнообразные экзогенные воздействия зависит от функционального состояния клеток. Одним из основных действующих факторов среды является световой. Соответственно, градиент освещенности или фотопериод будут существенно влиять на функциональную активность клеток культуры микроводоросли. Последнюю возможно оценивать по репродуктивной активности клеток. В связи с этим целью данной работы являлось исследование влияния фотопериода на репродуктивную активность клеток Dunaliella viridis Teod. при накопительном культивировании в условиях непрерывного освещения и свето-темновых циклов.
Материал и методы В исследовании использовали альгологически чистую культуру водоросли Dunaliella viridis var. palmelloides Teod. – штамм IMBR-5 из ЦКП «Коллекция гидробионтов Мирового океана» ФГБУН «Институт морских биологических исследований имени А.О. Ковалевского РАН». Культивирование осуществляли в накопительном режиме на питательной среде Тренкеншу (Тренкеншу, 1984). Выращивание микроводорослей проводилось на лабораторной установке для культивирования низших автотрофов (Тренкеншу и др., 2017) в стеклянных фитобиореакторах плоскопараллельного типа объемом 3 л с толщиной слоя культуры 5 см. В контрольном варианте выращивание проходило при непрерывном освещении, в опытном варианте – в условиях свето-темнового режима 20 ч : 4 ч (свет : темнота). Освещенность рабочей поверхности культиваторов составляла 10 кЛк, температура в светлое время 25–27 ºС, в темное время 24–25 ºС. Интенсивность освещения на поверхности культуры регистрировали однократно при помощи люксметра Ю-116, с погрешностью не более 5% от измеряемой величины. В процессе выращивания культуру непрерывно барботировали воздухом с помощью компрессорной установки. Отбор проб проводился ежедневно в начале и конце темнового периода, в двух повторностях. Перед отбором проб доводили уровень суспензии в культиваторе до метки дистиллированной водой для компенсации испарения. Измеряли оптическую плотность на фотоэлектроколориметре КФК-2 при длине волны 750 нм, в стеклянных кюветах 0,5 см. Абсолютно сухой вес (АСВ) вычисляли, используя коэффициент перехода от оптической плотности k = 0,8 г/л ед.опт.пл., АСВ = k × D750 (Боровков, 2008). Удельная скорость роста µ в экспоненциальной фазе рассчитана по формуле:
где Bln – биомасса в начале экспоненциальной фазы tln. Максимальную продуктивность культуры микроводорослей определяли по формуле:
где B – биомасса, мг · л-1; Pm – максимальная продуктивность, мг · л-1 · ч-1; t – время, ч.; B0 – биомасса в начале линейной фазы роста, т.е. при t = t0. Изменение удельной скорости роста со временем рассчитывали:
Время удвоения биомассы определяли по формуле (Тренкеншу, 2005):
где µ – удельная скорость деления, сут-1.
Численность клеток подсчитывали в камере Горяева БКГ-4 (Сиренко, 1975) на микроскопе Carl Ceiss Axiostar Plus при увеличении ×630. Измеряли высоту и ширину клеток в монадном состоянии и в фазе деления. Статистическую обработку данных выполняли с помощью стандартных программных пакетов Microsot Excel. Рассчитывали средние арифметические (x̅), стандартные отклонения (S), ошибку средней, доверительные интервалы для средних (Δ x̅). Все расчеты проводили для уровня значимости α = 0,05. В тексте и графиках представлены средние значения и рассчитанные доверительные интервалы (x̅ ±Δ x̅) (Лакин, 1990).
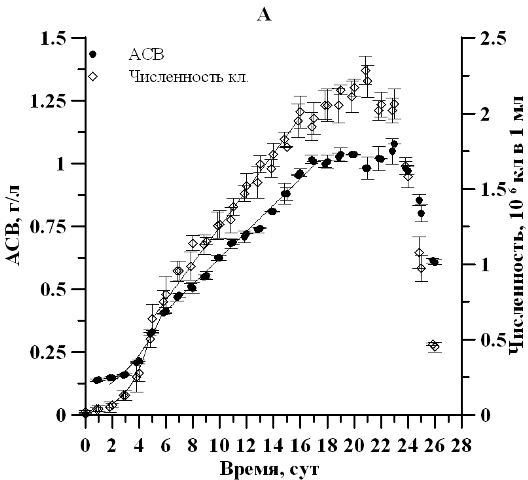
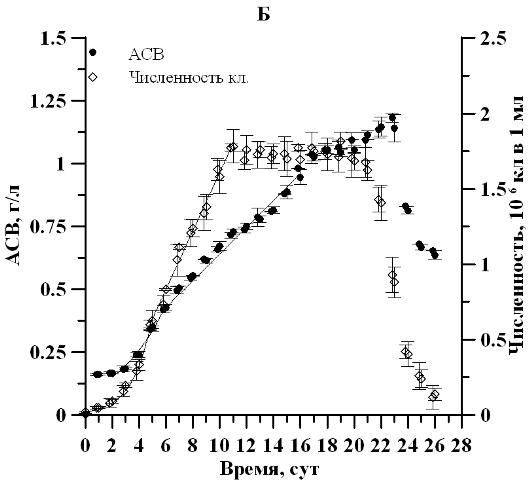
Результаты и обсуждение В ходе накопительного культивирования продуктивность, максимальная биомасса и соответствующая экспоненциальной фазе удельная скорость роста культуры в условиях непрерывного освещения и свето-темновых циклов существенным образом не отличались. Удельная скорость роста по численности клеток составила 0,67∙сутки-1 в контрольном и 0,69∙сутки-1 в опытном варианте. Продолжительность экспоненциальной фазы роста по плотности и репродуктивной активности клеток так же достоверно не отличалась и наблюдалась 1–5 сутки эксперимента (рис. 1).
Рис. 1. Динамика плотности и численности клеток клеток D. viridis в накопительной культуре при непрерывном освещениипри (А) и свето-темновых циклах (Б). Fig. 1. Dynamics of density and number of cells of cells D. viridis in batch culture under continuous illumination (А) and light-dark cycles (Б).
Отмечено, что продолжительность линейной фазы роста по численности клеток при постоянном освещении оказалась почти в два раза дольше. При этом максимальная продуктивность по численности клеток при свето-темновом режиме составила 0,19∙106 кл∙мл-1∙сутки-1, что в 1,6 раза выше, чем в контрольном варианте (0,12∙106 кл∙мл-1∙сутки-1). Это полностью согласуется с известными литературными данными (Масюк, 1973), свидетельствующими о росте репродуктивной активности водорослей в условиях свето-темнового периода по сравнению с условиями круглосуточного освещения. Отсутствие существенных различий на экспоненциальном и линейном участке по плотности культуры для двух вариантов эксперимента вероятно связанно с относительно коротким промежутком темнового режима либо явлением параллельного роста числа клеток и уменьшения их линейных размеров, что предстоит уточнить в последующих экспериментах. Рассчитанное по численности клеток время удвоения g2 в экспоненциальной фазе составило 1,0 сутки для двух вариантов опыта. На линейном участке можно отметить монотонное увеличение времени длительности вегетативной стадии. Так, к окончанию линейной фазы роста, время генерации при круглосуточном освещении и свето-темновом режиме увеличилось в 5,8 и 4 раза соответственно.
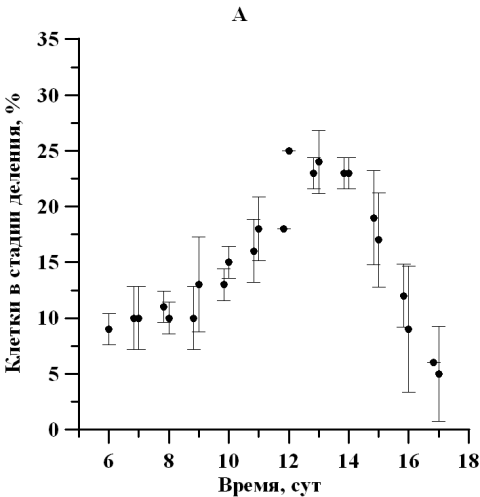
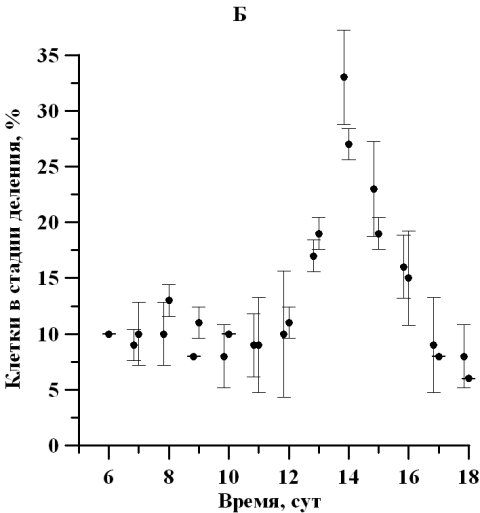
Рис. 2. Динамика доли клеток D. viridis в репродуктивной стадии на линейном участке при непрерывном освещении (А) и свето-темновых циклах (Б). Fig. 2. Dynamics of the percentage of dividing cells D. viridis in the reproductive stage in a linear area under continuous illumination (A) and light-dark cycles (B).
На протяжении линейной фазы роста отмечалось изменение физиологического состояния популяции D. viridis, сопровождающееся отслаиванием протопласта от клеточной оболочки, потерей жгутиков и способности к активному движению. Так, количество клеток, находящихся в репродуктивной фазе, к середине линейного участка увеличилось в 3 раза, а по окончании линейной фазы роста уменьшилось в 4 раза. Так как данная закономерность характерна для обоих вариантов исследования, то наиболее вероятно влияющим фактором является обеспеченность минеральным субстратом либо одновременное влияние лимитирования субстратом и ингибирования метаболитами. Максимальная доля делящихся клеток при постоянном освещении и свето-темновом режиме составила 25 ± 0,01 и 33 ± 4% соответственно (рис. 2). Можно отметить, что увеличение доли делящихся клеток, вероятно, определяет и изменение продуктивности, также увеличивающейся в середине линейного участка роста (Тренкеншу и др., 2018).
Заключение Исследование D. viridis при накопительном культивировании в условиях непрерывного освещения и свето-темновых циклов показало, что отсутствие существенных различий в двух вариантах опыта по плотности вероятно связанно с относительно коротким промежутком темнового режима. При этом максимальная продуктивность по численности клеток D. viridis при свето-темновом режиме оказалась в 1,6 раза выше, чем при постоянном освещении. Установлено, что максимальный процент делящихся клеток на линейном участке составил 25% при непрерывном освещении и 35% при свето-темновом режиме.
Работа подготовлена по теме государственного задания ФГБУН ИМБИ «Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса», номер гос. регистрации АААА-А18-118021350003-6»
Список литературы 1. Боровков А.Б. Динамика пигментов и роста морских микроводорослей в хемостате на примере Dunaliella salina Teod.: Автореф. дис. канд. биол. наук. – Севастополь, 2008. – 31 с. 2. Десницкий А.Г. Клеточные циклы и синтез ДНК в культурах динофлагеллят // Цитология. 1988. Т.ХХХ. №9. С. 1035–1041. 3. Комаристая В.П., Божков А.И., Догадина Т.В. Интенсивность синтеза нуклеиновых кислот у водорослей рода Dunaliella в процессе периодического культивирования // Альгология. 1997. Т.7, №4. С. 350–357. 4. Лакин Г.Ф. Биометрия: Учеб. пособие для биол. спец. вузов. 4-е издание. – М.: Высш. школа, 1990. – 352 с. 5. Лось Д.А., Захледер В., Купцова Е.С., Ксенофонтов А.Л., Маркелова А.Г., Шапигузов Ю.М., Семененко В.Е. Влияние спектрального состава света на репликацию хлоропластной ДНК и деление хлоропластных нуклеоидов зеленой водоросли Dunaliella salina // Физиология растений. 1990. Т.37. Вып.2. С. 1045–1052. 6. Масюк Н.П. Морфология, систематика, экология, географическое распространение рода Dunaliella Teod. – Киев: Наукова думка, 1973. – 487 с. 7. Масюк Н.П., Посудин Ю.И., Лилицкая Г.Г. Фотодвижение клеток Dunaliella Teod. (Dunaliellales, Chlorophyceae, Viridiplantae). – Киев: Академ-периодика, 2007. – 264 с. 8. Сиренко Л.А. Методы физиолого-биохимического исследования водорослей в гидробиологической практике. – Киев: Наукова думка, 1975. – 247 с. 9. Тренкеншу Р.П. Ростовые и фотоэнергетические характеристики морских микроводорослей в плотной культуре: Автореф. дис. канд. биол. наук. – Красноярск, 1984. – 28 с. 10. Тренкеншу Р.П. Простейшие модели роста микроводорослей. 1. Периодическая культура // Экология моря. 2005. Вып.67. С. 89–97. 12. Тренкеншу Р.П., Лелеков А.С., Новикова Т.М. Линейный рост морских микроводорослей в культуре // Морской биологический журнал. 2018. Т.3, № 1. – (В печати). Статья поступила в редакцию 15.12.2017
Reproductive activity of Dunaliella viridis Teod. cells in a batch culture under continuous illumination and light-dark cycles Olga A. Memetshaeva, Andrey B. Borovkov Kovalevsky Institute of Marine Biological Research of RAS (Sevastopol, Russia) Experimental studies have shown that with light-dark mode, the maximum productivity by the number of cells was 1.6 times higher than under constant illumination. Specifically, the maximum percentage of cells in the reproductive phase in the linear section, with continuous illumination, was 25% and 33% with light-dark mode, which is 1.3 times higher. Key words: Dunaliella viridis; density; number; division; batch culture; continuous lighting; light-dark mode.
Об авторах Меметшаева Ольга Александровна - Memetshaeva Olga A. ведущий инженер (аспирант), Институт морских биологических исследований им. А.О. Ковалевского РАН, Севастополь, Россия (Kovalevsky Institute of Marine Biological Research of RAS, Sevastopol, Russia), Отдел биотехнологий и фиторесурсов olga.memetshaeva@mail.ru Боровков Андрей Борисович - Borovkov Andrey B. кандидат биологических наук spirit2000sev@yandex.ru
ССЫЛКА НА СТАТЬЮ: Меметшаева О. А., Боровков А. Б. Репродуктивная активность клеток Dunaliella viridis Teod. в накопительной культуре при непрерывном освещении и свето-темновых циклах // Вопросы современной альгологии. 2018. № 1 (16). URL: http://algology.ru/1262 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ 
|
|||||||
|
| ||||||