|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VI Сабининские чтения 1 ноября - 15 декабря 2017 г. Цианобактерии озера Байкал – продуценты эругинозинов
Ивачева М.А.1,2, Тихонова И.В.1, Кузьмин А.В.1, Сороковикова Е.Г.1, Maria A. Ivacheva, Irina V. Tikhonova, Anton V. Kuzmin,
1Лимнологический институт СО РАН (Иркутск, Россия)
УДК 581.526.325.2
Цианобактерии продуцируют широкий спектр биологически активных веществ, которые могут быть использованы в медицине и биологии в качестве ингибиторов различных ферментов. Одними из таких веществ являются эругинозины – ингибиторы сериновых (трипсиновых) протеаз. Помимо этого, эругинозины участвуют в противовоспалительной и антимикробной защите эпителия, поддержании барьерной функции эпидермиса и защите растений от вредителей. В настоящей работе исследованы культуры бентосных цианобактерий озера Байкал с целью выявления видов-продуцентов этих биологически активных веществ. Ключевые слова: озеро Байкал; бентосные цианобактерии; эругинозины; MALDI-TOF/TOF.
Введение Байкал – уникальный древнейший водоем мира, возраст его около 30 млн лет. Это самое глубокое и прозрачное озеро на Земном шаре, глубина его достигает 1620 м, диск Секки виден до 40 м, а температура воды в глубинных слоях составляет 3°С (Байкал, 1993). Озеро Байкал, несмотря на олиготрофность и холодноводность, – подходящая экологическая ниша для цианобактерий, одного из важнейших звеньев трофической сети озера (Белых и др., 2011). Цианобактерии производят большое количество веществ, которые обладают как токсическими, так и полезными фармакологическими активностями (Волошко, Пиневич, 2014), поэтому изучение вторичных метаболитов цианобактерий, обладающих медико-биологическими свойствами – перспективное направление современной биологии. Одними из перспективных цианобактериальных метаболитов являются эругинозины (Wang, Goyal, 2009). Эругинозины способны ингибировать такие сериновые протеазы, как тромбин, протеазы раковых клеток определенных линий и др. (Namikoshi, Rinehart, 1996; Tummala et al., 2016). По химической структуре они являются линейными пептидами и встречаются у пресноводных и морских цианобактерий. Для них характерно наличие Choi-фрагмента – химической группы, за счет которой различаются эругинозины и спумигины (Throst, 2012). Данная диагностическая группа – продукт биосинтетических путей нерибосомной синтетазы (NRPS) (Fewer et al., 2009; Elkobi-Peer, 2013). Известно, что штаммы цианобактерий, способных формировать биопленки, содержат большее количество генов синтеза вторичных метаболитов по сравнению с планктонными (Kurmayer et al., 2016). С недавнего времени, в связи с эвтрофикацией озера отмечено массовое развитие бентосных цианобактерий порядков Nostocales и Oscillatoriales, ранее не встречавшихся в таком количестве, а также способных к синтезу токсинов (Belykh et al., 2016, Ивачева и др., 2016; Белых и др., 2017). Поскольку наиболее пристальное внимание исследователей привлекают токсины в силу их опасного воздействия на организм животных и человека, остальные биологически активные вещества изучены слабо. Целью настоящей работы является поиск нерибосомных пептидов – эругинозинов – у бентосных цианобактерий озера Байкал при помощи методов аналитической химии.
Материалы и методы Монокультуры байкальских цианобактерий получали на среде Z-8 (Rippka, 1988). Бентосные цианобактерии, обрастающие дно Байкала, отбирали при помощи водолазов-исследователей в сентябре–октябре 2015 г. в районе поселков Листвянка и Большие Коты. Биомассу рассевали на 1% агаризованную среду Z-8. Культивирование осуществляли в уникальной научной установке ЛИН СО РАН «Экспериментальный пресноводный аквариумный комплекс байкальских гидробионтов» (ПАК) (http://lin.irk.ru/aqua). Световой режим составлял чередование ночного и дневного (освещенность 1000−1500 люкс, лампа дневного света) периодов, температура культивирования 11−12°C. Масс-спектрометрический анализ проводили на базе ЦКП «Ультрамикроанализ» ЛИН СО РАН. Биомассу цианобактерий освобождали от среды центрифугированием, осадок высушивали и переносили в пластиковые пробирки объемом 50 мл, добавляли двукратный избыток дистиллированной воды по отношению к объему осадка и многократно (не менее 20 раз) подвергали процедуре замораживания-оттаивания, контроль извлечения внутриклеточного содержимого осуществляли под световым микроскопом ZEISS (Germany). К полученной смеси добавляли необходимое количество метанола до концентрации 75% (v.) и экстрагировали в ультразвуковой бане в течение 1 часа. Супернатант отделяли центрифугированием, осадок повторно экстрагировали. Экстракты объединяли, упаривая досуха на роторном испарителе, и перерастворяли в 75%-ном метаноле (в расчете 400 мкл 75% метанола на 100 мг образца). Состав метаболитов анализировали на масс-спектрометре MALDI-TOF/TOF «UltrafleXtreme», («Bruker Daltonics GmbH», Германия). Детектирование выполнено в режиме регистрации положительных ионов. Диапазон регистрируемых масс 100−3500 Да. Регистрацию MС2-спектров проводили в LIFT-режиме.
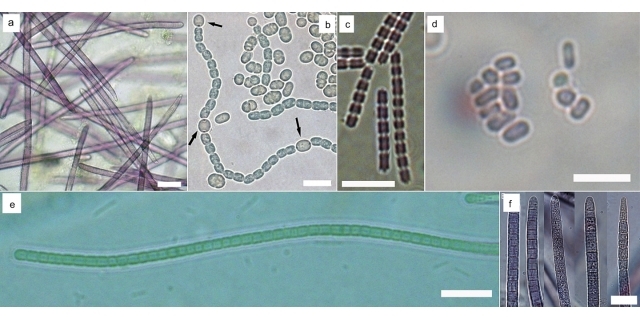
Результаты и обсуждение Было получено шесть штаммов бентосных цианобактерий: Synechococcus sp. BF2, Symplocastrum sp. BK, Tychonema sp. OI, Leptolyngbya sp. PS, Pseudanabaena galeata LV. Также для сравнения со способностью планктонных цианобактерий продуцировать эругинозины был выбран ранее полученный штамм Trichormus variabilis 9610 (Гладких и др., 2008). Цианобактерии рода Tychonema (Anagnostidis & Komárek, 1988) впервые зарегистрированы в озере Байкал в период экологического кризиса в прибрежной зоне (Belykh et al., 2016; Белых и др., 2017). Данный вид формирует биопленки на больных губках. Трихомы штамма Tychonema sp. OI красно-фиолетового цвета, без перетяжек, постепенно суженные к концу, прямые или слегка загнутые. Диаметр клеток в середине трихома (5,3) 6 – 6,9 (7,3) мкм, в конце трихома – (3,5) 3,9 – 5 (5,7) мкм, длина клеток в 1,5 раза меньше ширины трихома – (2,8) 3,4–4,7 (5,1) мкм (рис. 1а). Trichormus variabilis (Kützing ex Bornet & Flahault 1989) является типичным представителем планктона озера Байкал. Штамм T. variabilis 9610 имеет следующую морфологию: часть клеток трихома дифференцирована в гетероцисты (рис. 1b). Тилакоиды извитые, распределены по всей клетке, фикобилисомы и газовые вакуоли отсутствуют, зона нуклеоида не выражена. Включения в клетках не локализованы и представлены гранулами полифосфатов, цианофициновыми гранулами и полиэдральными телами. Клеточная стенка тонкая, четырехслойная. Из клеточных покровов имеется гликокаликс – фибриллы слизи, окружающие клетки. Цианобактерия Pseudanabaena galeata (Böcher 1949) – космополитный вид, обитающий в пресноводных эвтрофных и мезотрофных водоемах. Диаметр клеток полученного нами штамма P. galeata LV составлял 1,8–2,4 (2,8) мкм, длина клеток почти равна или в 2 раза больше ширины трихома – (1,6) 2,2–3,4 (4,2) мкм (рис. 1с). Род Synechococcus (Nägeli 1849) – один из самых распространенных в планктоне озера Байкал. Бентосный представитель этого рода – цианобактерия Synechococcus sp. BF2 имеет клетки красного цвета, овальные до палочковидных, одиночные и собранные в агрегаты, объединенные слизью (рис. 1d). При выращивании в жидкой среде штамм способен к формированию биопленок на стекле. Размножаются делением пополам, образуя цепочки из 2–6 клеток. Диаметр клеток составляет (0,8) 1 – 1,6 (1,9) мкм, длина клеток почти равна или в 2 раза больше ширины – (1,1) 1,8 – 3,1 (4,6) мкм. Цианобактерии рода Leptolyngbya (Anagnostidis & Komárek 1988) – самые часто встречающиеся в бентосных пробах из озера Байкал. Цианобактерии штамма Leptolyngbya sp. PS росли на твердой и жидкой среде в виде пленок зеленого цвета. Трихомы прямые или извитые, с перетяжками, конечная клетка закругленная (рис. 1e). Чехлы тонкие, иногда отсутствуют. Диаметр клеток составляет 2,9–3,3 (3,5) мкм, длина клеток равна или чуть меньше ширины – (1,5) 2 – 2,6 (3) мкм. Цианобактерия рода Symplocastrum (Kirchner 1898), представленная в нашей работе, в жидкой среде развивается в виде тонкой пленки, а затем формирует шаровидные ризоидные колонии до 7 мм в диаметре. Трихомы штамма Symplocastrum sp. BK красно-фиолетового цвета, часто заключены в открытый на конце чехол, встречаются как одиночные трихомы, так и группы из 2–6 трихомов, заключенные помимо индивидуальных чехлов в общее открытое влагалище. Группы трихомов могут расщепляться, формируя in situ характерные кустистые колонии размером до 3 см. Трихомы прямые, с неглубокими перетяжками, иногда сужены к концу, форма конечной клетки отличается полиморфизмом (рис. 1f), но чаще она закругленная или округло-конусовидная. Диаметр клеток трихома (7) 8,9 – 12,5 (13,7) мкм, длина клеток обычно в 2 раза меньше или почти равна ширине трихома – (2) 4,5–8,5 (10) мкм.
Рис. 1. Световая микроскопия полученных штаммов бентосных цианобактерий: Fig. 1. Light microscopy of benthic cyanobacteria:
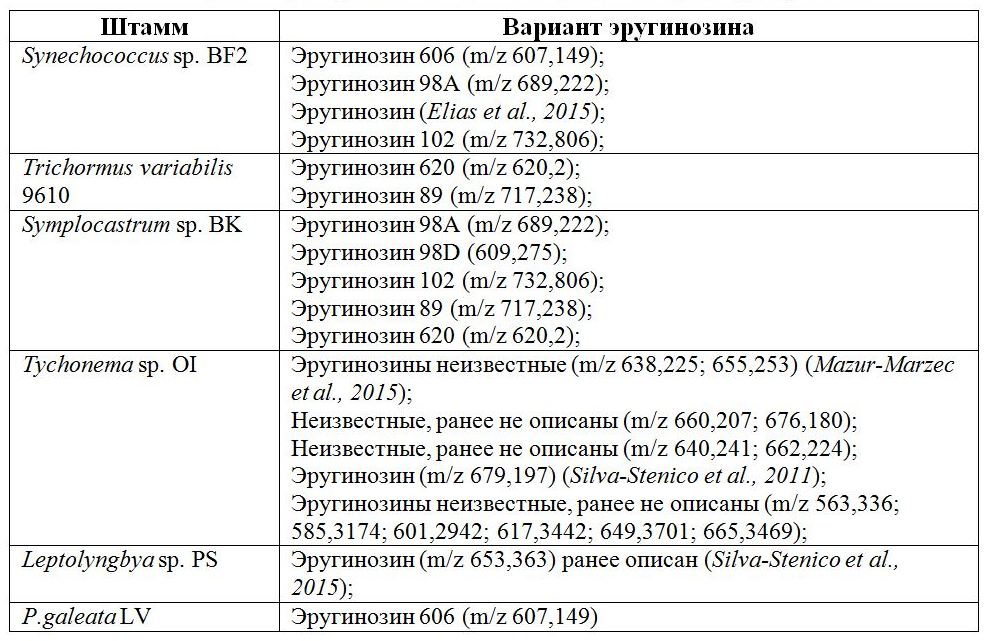
С помощью MALDI-TOF/TOF анализа в экстрактах биомассы культур обнаружено 24 различных варианта эругинозинов, 8 из которых – ранее неизвестные (Табл.).
Таблица. Варианты эругинозинов у различных штаммов бентосных цианобактерий Table. Variants of aeruginosins in various strains of benthic cyanobacteria
Эругинозины были единственными пептидными метаболитами планктонного штамма Trichormus variabilis 9610, активно развивающегося летом при дефиците азота в воде. Для этой цианобактерии характерны варианты с массами 620 и 89, встречающиеся только у штамма Symplocastrum sp. BK. Эругинозин 89 способен ингибировать не только тромбин, но и трипсин (Wang, Goyal, 2009). Всего по одному варианту эругинозинов обнаружено у цианобактерий штаммов Leptolyngbya sp. PS и P. galeata LV, однако все эти варианты были с высокими молекулярными массами – 606 и 653. Наибольшее количество известных вариантов зарегистрировано у цианобактерий штамма Symplocastrum sp. BK. Цианобактерии этого штамма обладают ярко выраженными способностями формировать пленчатые обрастания, в природе они активно колонизируют дно озера Байкал и эндемичные байкальские губки. У цианобактерий штамма Tychonema sp. OI обнаружена способность к синтезу эругинозинов с молекулярной массой свыше 600, некоторые из вариантов описаны ранее у цианобактерий Sphaerocavum brasiliense (De Azevedo & C.L.Sant' Anna 2003), выделенных из пресных эвтрофных водоемов Бразилии. Также было обнаружено десять новых для науки вариантов. Представители штамма Synechococcus sp. BF2 и P. galeata LV продуцируют эругинозин 606, имеющий подтверждение своей биологической активности против трипсина и тромбина (Vegman, Carmeli, 2014). Цианобактерии штаммов Synechococcus sp. BF2 и Symplocastrum sp. BK способны к синтезу эругинозина 98А, впервые изолированному из штамма пресноводных цианобактерий Microcystis aeruginosa (Kützing 1846) (Murakami et al., 1995). Они синтезируют эругинозин 102, который обладает способностью ингибировать трипсин, а также тромбин и плазмин (Namikoshi, Rinehart, 1996). Эругинозины 98А и 102 тестированы на ингибиторную активность, был выявлен их антитрипсиновый, антиплазминовый и антитромбиновый эффект. Таким образом, байкальские цианобактерии синтезируют значительное количество фармакологически значимых нерибосомных пептидов – эругинозинов. Нам не удалось идентифицировать исследуемые штаммы цианобактерий (кроме P. galeata LV) до вида, что позволяет предположить, что это новые представители родов. Самый широкий спектр вариантов эругинозинов синтезируют цианобактерии рода Tychonema. Также у данного штамма встречается наибольшее число ранее неизвестных вариантов, которые необходимо дополнительно исследовать с целью выявления структуры и свойств. К настоящему времени структура и ингибирующая активность эругинозинов в отношении ферментов свертывания крови установлена для вариантов с молекулярной массой 89, 98, 101,102, 205 и 298, пептиды с массами свыше 600 не исследовались. Следует отметить, что биологическое значение эругинозина для самих цианобактерий до сих пор неизвестно. Предполагается, что это внутренний сигнал цианобактерий, способствующий колонизации выбранной экологической ниши. Возможно, наличие такого количества биологически активных веществ у бентосных цианобактерий оказывает влияние и на байкальскую эндемичную губку посредством ингибирования ферментативных путей, приводя к ее ослаблению и гибели.
Работа выполнена в рамках грантов РФФИ № 16-54-44035 и гос. заданий № 0345-2016-0003, № 0345-2016-0005.
Список литературы 1. Байкал (Атлас) // Г.И. Галазия (ред.) – Изд-во Федеральной службы геодезии и картографии России, 1993. – 160 с. 2. Белых О.И., Тихонова И.В., Сороковикова Е.Г., Щербакова Т.А., Курейшевич А.В. Пикопланктонные Cyanoprokaryota родов Synechococcus и Cyanobium из озера Байкал (Россия) // Альгология. 2011. Т.21. С. 36–50. – http://lin.irk.ru/pdf/10601.pdf (дата обращения: 21.11.2017). 3. Белых О.И., Фёдорова Г.А., Кузьмин А.В., Тихонова И.В., Тимошкин О.А., Сороковикова Е.Г. Обнаружение микроцистинов в цианобактериальных обрастаниях различных субстратов прибрежной зоны озера Байкал // Вестник Московского университета. 2017. Т.72 № 4. С. 262−269. http://lin.irk.ru/pdf/70137.pdf (дата обращения – 26. 11. 2017). 4. Волошко Л.А., Пиневич А.В. Разнообразие токсинов цианобактерий // Астраханский вестник экологического образования. 2014. T.1. C. 68–80. 5. Гладких A.С., Белых О.И., Клименков И.В., Тихонова И.В. Азотфиксирующая цианобактерия Trichormus variabilis в фитопланктоне озера Байкал // Микробиология. 2008. Т.77. С. 1–9. 6. Ивачева М.А., Тихонова И.В., Сороковикова Е.Г., Краснопеев А.Ю., Потапов С.А., Чойдаш Б., Белых О.И. Микроцистин-продуцирующие цианобактерии в бентосе озера Байкал // Известия ИГУ. Серия «Биология. Экология». 2016. Т.17. С. 38–44. http://lin.irk.ru/pdf/13581.pdf (дата обращения – 23.11.2017). 7. Belykh O.I., Tikhonova I.V., Kuzmin A.V., Sorokovikova E.G., Fedorova G.A., Khanaev I.V., Sherbakova T.A., Timoshkin O.A. First detection of benthic cyanobacteria in Lake Baikal producing paralytic shellfish toxins // Toxicon. 2016. V.121. P. 36–40. http://lin.irk.ru/pdf/13388.pdf (дата обращения – 23.11.2017). 8. Elias L.M., Silva-Stenico M., Alvarenga D., Rigonato J., Fiore M., Possedente de Lira S. Molecular and Chemical Analyses of Cyanobacterial Blooms in Tropical Lagoons from Southeast Brazil // Journal of Water Resource and Protection. 2015. V.7, № 1. P. 21. 9. Elkobi-Peer S., Singh R.K., Mohapatra T.M., Tiwari S.P., Carmeli S. Aeruginosins from a Microcystis sp. Bloom Material Collected in Varanasi, India // Nat. Prod. 2013. V.76. P. 1187−1190. 10. Fewer D.P., Jokela J., Rouhiainen L., Wahlsten M., Koskenniemi K., Stal L. J., Sivonen K. The non-ribosomal assembly and frequent occurrence of the protease inhibitors spumigins in the bloom-forming cyanobacterium Nodularia spumigena // Mol. Microbiol. 2009. V.73. P. 924–937. 11. Komárek J., Anagnostidis K. Cyanoprokaryota - 1. Teil: Chroococcales. In Ettl, H., J. Gerloff, H. Heynig & D. Mollenhauer (eds) Süβwasserflora von Mitteleuropa, Bd 19/1. – Gustav Fischer Verlag, 1999. – 548 p. 12. Komárek J., Anagnostidis K., Cyanoprokaryota - 2. Teil: Oscillatoriales. In Büdel, B., L. Krienitz, G. Gärtner & M. Schagerl (eds) Süβwasserflora von Mitteleuropa, Band 19/2. – Elsevier/Spektrum, Heidelberg, 2005. – 759 p. 13. Kurmayer D., Deng L., Entfellner E. Role of toxic and bioactive secondary metabolites in colonization and bloom formation by filamentous cyanobacteria Planktothrix // Harmful Algae. 2016. V.54. P. 69–86. 14. Mazur-Marzec Н. Błaszczyk A., Felczykowska A., Hohlfeld N., Kobos J., Toruńska-Sitarz A. Baltic cyanobacteria – a source of biologically active compounds // European Journal of Phycology. 2015. V.50. P. 343–360. 15. Murakami M., Ishida K., Okino T., Okita Y., Matsuda H., Yamaguchi K. Aeruginosins 98-A and B, trypsin inhibitors from the blue-green alga Microcystis aeruginosa (NIES-98) // Tetrahedron. 1995. V.36. P. 2785–2788. 16. Namikoshi M., Rinehart K.L. Bioactive compounds produced by cyanobacteria // J. Industr. Microbiol. Biotechn. 1996. V.17. P. 373−384. 17. Rippka R. Isolation and purification of cyanobacteria // Methods of Enzymology. 1988. V.167. P. 28–67. 18. Silva-Stenico M.E., Rigonato J., Lorenzi A.S., Azevedo M.T.P., Sant’Anna C.L., Fiore C.L.M.F. Bioactive Cyanopeptides Produced by Sphaerocavum brasiliense Strains (Cyanobacteria) // Journal of the Brazilian Chemical Society. 2015. V.26, №10. P. 2088–2096. 19. Silva-Stenico M.E., Silva C.S., Lorenzi A.S., Shishido T.K., Etchegaray A., Lira S.P., Moraes L.A., Fiore M.F. Non-ribosomal peptides produced by Brazilian cyanobacterial isolates with antimicrobial activity // Microbiological Research. 2011. V.166. P. 161–175. 20. Trost B.M., Kaneko T., Andersen N.G., Tappertzhofen C., Fahr B. Total Synthesis of Aeruginosin 98B // American Chemical Society. 2012. V.134. P. 18944–18947. 21. Tummala R., Kavtaradze A., Gupta A., Ghosh R.K. Specific antidotes against direct oral anticoagulants: A comprehensive review of clinical trials data // International Journal of Cardiology. 2016. V.104. P. 292–298. 22. Vegman M., Carmeli S. Three aeruginosins and a microviridin from a bloom assembly of Microcystis spp. collected from a fishpond near Kibbutz Lehavot HaBashan, Israel // Tetrahedron. 2014.V.70. P. 6817–6824. 23. Wang G., Goyal N. Aeruginosin analogs and other compounds with rigid bicyclic structure as potential antithrombotic agents // Cardiovasc Hematol Agents Med Chem. 2009. V.7. P. 147–165. Статья поступила в редакцию 7.12.2017
Aeruginosin-producing Cyanobacteria in the Benthos of Lake Baikal Maria A. Ivacheva1,2, Irina V. Tikhonova1, Anton V. Kuzmin1, Ekaterina G. Sorokovikova1, Sergey A. Potapov1, Andrei Y. Krasnopeev1,3, Battsetseg Choidash4, Olga I. Belykh1 1Limnological Institute SB RAS (Irkutsk, Russia)
Cyanobacteria produce a wide range of biologically active substances that can be used in medicine and biology as inhibitors of various enzymes. One of such substances are aeruginosins − inhibitors of serine (trypsin) proteases. In addition, the aeruginosins are involved in the anti-inflammatory and antimicrobial protection of the epithelium, the maintenance of the barrier function of the epidermis and are a component of the mechanism of protection against pests in plants. The investigation presents new data about benthic cyanobacteria of Lake Baikal with the aim of revealing the species-producers of these biologically active substances. Key words: Lake Baikal; benthic cyanobacteria; aeruginosins; MALDI-TOF/TOF.
Об авторах Ивачева Мария Александровна − Ivacheva Maria A. студент магистратуры, Иркутский Государственный Университет (Irkutsk State University, Irkutsk, Russia); ведущий инженер, Лимнологический институт СО РАН (Limnological Institute SB RAS, Irkutsk, Russia), лаборатория водной микробиологии ivacevam@gmail.com Тихонова Ирина Васильевна − Tikhonova Irina V. кандидат биологических наук iren@lin.irk.ru Кузьмин Антон Васильевич − Kuzmin Anton V. кандидат химических наук kuzmin200av@gmail.com Сороковикова Екатерина Георгиевна − Sorokovikova Ekaterina G. кандидат биологических наук kati_sor@mail.ru Краснопеев Андрей Юрьевич − Krasnopeev Andrei Yu. студент магистратуры, Иркутский национальный исследовательский технический университет (National Research Irkutsk State Technical University, Irkutsk, Russia); ведущий инженер, Лимнологический институт СО РАН (Limnological Institute SB RAS, Irkutsk, Russia), лаборатория водной микробиологии andrewkrasnopeev@gmail.com Потапов Сергей Анатольевич − Potapov Sergey A. научный сотрудник, Лимнологический институт СО РАН (Limnological Institute SB RAS, Irkutsk, Russia) poet1988@list.ru Чойдаш Батцецег – Choidash Battsetseg кандидат биологических наук battsetseg@num.edu.mn Белых Ольга Ивановна − Belykh Olga I. кандидат биологических наук belykh@lin.irk.ru Корреспондентский адрес: 664033, г. Иркутск, ул. Улан-Баторская, 3, ЛИН СО РАН; тел. (3952) 42–54–15.
ССЫЛКА НА СТАТЬЮ: Ивачева М.А., Тихонова И.В., Кузьмин А.В., Сороковикова Е.Г., Потапов C.A., Краснопеев А.Ю., Чойдаш Б., Белых О.И. Цианобактерии озера Байкал – продуценты эругинозинов // Вопросы современной альгологии. 2018. № 1 (16). URL: http://algology.ru/1251 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ 
|
|||
|
| ||