|
|
|
|
V Сабининские чтения 29 ноября 2016 - 29 января 2017 Морфометрические характеристики клеток микроводоросли Dunaliella viridis в накопительной культуре
Мальцева О.А. Olga A. Maltceva
Институт морских биологических исследований им. А.О.Ковалевского (г. Севастополь)
УДК 528.263:581.4
Исследованы морфологические и количественные характеристики Dunaliella viridis при накопительном культивировании в условиях непрерывного освещения. Определены крайние значения максимальной биомассы, численности клеток и динамика их соотношения. Выявлено, что на протяжении линейной фазы роста средняя высота клеток и процентное содержание клеток с максимальной высотой остается неизменной, а средняя ширина клеток и содержание клеток с максимальной шириной уменьшается в 1,1 и 1,2 раза соответственно. Определено, что максимальный процент делящихся клеток на линейном участке составил 25%. Ключевые слова: Dunaliella viridis; биомасса; численность; высота и ширина клеток; деление; накопительная культура; непрерывное освещение.
Введение Представители рода Dunaliella относятся к классу Chlorophyceae и широко используются для получения каротиноидов, глицерина, полиненасыщенных жирных кислот, липидов, витаминов и других биологически активных веществ (Tran et al., 2013), а также представляют практический и теоретический интерес как объект для изучения процессов биосинтеза каротина β, механизмов осморегуляции, солеустойчивости, морозоустойчивости и др. (Ben-Amotz et al., 1989; Масюк, 1973; Боровков, 2005). Размеры клеток в среднем составляет 9-12 х 6-12 мкм. Форма клеток эллипсоидная, яйцевидная или грушевидная, с двумя жгутиками на апикальном конце клетки. Для Dunaliella характерны вегетативный, бесполый и половой тип размножения. Первый является преобладающим, происходит путём поперечного деления клеток. Dunaliella viridis Teod является широко распространенным и легко культивируемым видом, благодаря отсутствию склонности к механическим повреждениям в результате перемешивания при наращивании в больших объемах. Отсутствие целлюлозной и пектиновой оболочки и наличие тонкой бесцветной протоплазматической мембраны позволяет рассмотреть органеллы клетки (хлоропласта) и даёт возможность зафиксировать деление клетки на различных стадиях, что делает микроводоросль хорошим объектом для исследования (Масюк и др., 2007). Целью работы являлось исследование репродуктивной активности клеток и динамики биомассы Dunaliella viridis для определения морфометрических характеристик роста клеток микроводорослей в накопительной культуре при непрерывном освещении.
Материал и методы В эксперименте использовали альгологически чистую культуру водоросли Dunaliella viridis var. palmelloides Teod. – штамм IMBR-5 из коллекции культур микроводорослей ФГБУН ИМБИ им. А.О. Ковалевского РАН. Культивирование осуществляли в накопительном режиме на питательной среде Тренкеншу (Тренкеншу, 1984). Выращивание микроводорослей проводилось на лабораторной установке для культивирования низших автотрофов (Тренкеншу и др., 2009) в стеклянных фитобиореакторах плоскопараллельного типа объемом 3 л с толщиной слоя культуры 5 см. Интенсивность освещения на поверхности культуры регистрировали однократно при помощи люксметра Ю-116, с погрешностью не более 5% от измеряемой величины. Средняя освещённость на протяжении всего эксперимента составляла 10 кЛк. Температура в среднем составляла 24-26°С. В процессе выращивания культуру непрерывно барботировали воздухом с помощью компрессорной установки. Отбор проб проводили ежедневно в 11 и 15 часов, в двух повторностях. Перед отбором проб доводили уровень суспензии в культиваторе до метки дистиллированной водой для компенсации испарения. Измеряли оптическую плотность при длине волны 750 нм (D750) на фотоэлектроколориметре КФК-2 в стеклянных кюветах 0,5 см. Абсолютно сухой вес (АСВ) вычисляли, используя коэффициент перехода от оптической плотности k = 0,8 г/л ед.опт.пл., АСВ = k × D750 (Боровков, 2008). Удельная скорость роста µ в экспоненциальной фазе рассчитана по формуле:
где Bln – концентрация биомассы в момент времени tln. Максимальную продуктивность культуры микроводорослей определяли по формуле (Тренкеншу, 2005):
где B – биомасса, мг · л-1; Pm – максимальная продуктивность, мг · л-1 · ч-1; t – время, ч.; B0 – биомасса в начале линейной фазы роста, т.е. при t = t0. Изменение удельной скорости роста со временем рассчитывали:
Время удвоения биомассы определяли по формуле (Тренкеншу, 2005):
где µ – удельная скорость деления, сут-1. Численность клеток подсчитывали в камере Горяева БКГ-4 (Сиренко, 1975) на микроскопе МПБ-10 с бинокулярной насадкой 10× и объективом 40×. Морфометрические измерения микроводорослей проводили на микроскопе Carl Ceiss Axiostar Plus с бинокулярной насадкой 10×, объективами 20× и 63×. Измеряли высоту и ширину клеток в монадном состоянии и в фазе деления.
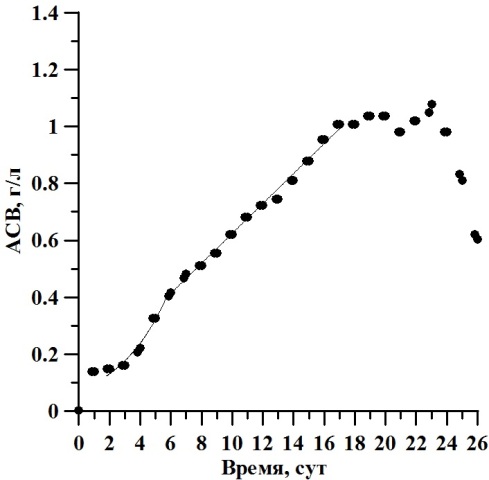
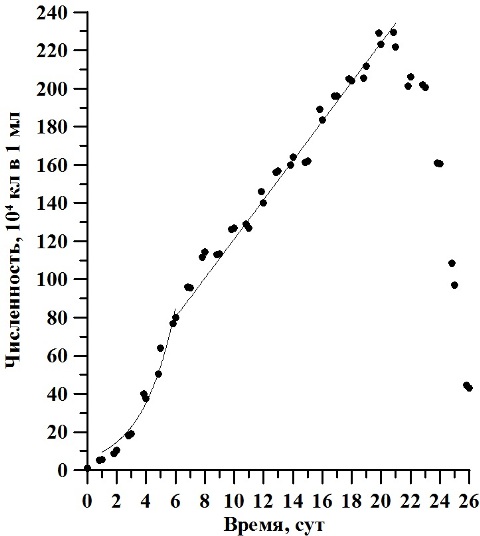
Результаты и обсуждение В ходе накопительного культивирования биомасса культуры D. viridis изменялась от 0,003 до 0,603 г/л АСВ, с максимумом 1,2 г/л АСВ на 23 сутки эксперимента (рис. 1). Экспоненциальная фаза роста продолжалась со 2 по 6 сутки эксперимента, а соответствующая ей удельная скорость роста биомассы µ составила 0,3 сут-1. Линейная фаза наблюдалась с 6 по 17 сутки культивирования, при этом максимальная продуктивность составила 0,5 г·л-1·сут-1. Численность клеток варьировала от 1,0·104 кл/мл в начале эксперимента и до 229,5·104 кл/мл на двадцатые сутки. Её среднее значение составляло 126,9·104 кл/мл (рис. 2). Соответствующая экспоненциальной фазе удельная скорость роста биомассы µ составила 0,43 сут-1. Продолжительность линейной фазы роста по численности клеток продолжалось с 6 по 21 сутки эксперимента, что в 1,6 раза больше, чем по биомассе. В этот период величина продуктивности Pm составила 10,27∙104 кл∙мл-1∙сутки-1. Рассчитанное по численности клеток время удвоения биомассы g2 в экспоненциальной фазе составило 1,61 сут-1.
Рис. 1. Динамика биомассы D. viridis в накопительной культуре при непрерывном освещении. Fig. 1. Dynamics of biomass D. viridis in batch culture under continuous light.
Рис. 2. Динамика численности клеток D. viridis в накопительной культуре при непрерывном освещении.
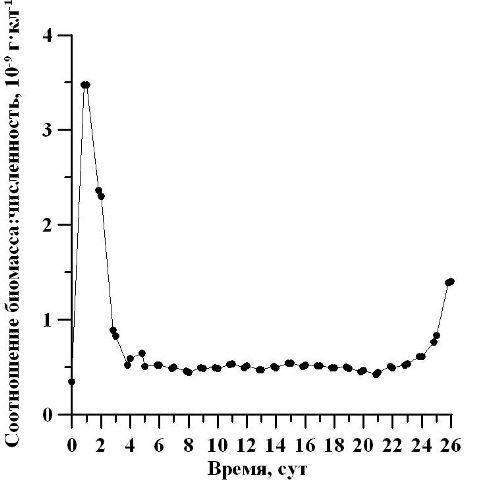
Установлено, что соотношение биомассы и численности клеток в течение первых трёх суток культивирования снижалось, а в последние двое суток – повышалось (рис. 3). С 5 по 23 сутки эксперимента культура находилась на одном и том же уровне соотношения (0,44-0,54×10-9 г/кл). Таким образом, после окончания экспоненциальной и завершения стационарной фаз анализируемое соотношение между биомассой и численностью клеток не менялось, что может свидетельствовать об отсутствии изменений средних размеров клеток в данный период.
Рис. 3. Динамика соотношения биомассы и численности клеток D. viridis. Fig. 3. Dynamics of biomass and number of ratio D. viridis cells.
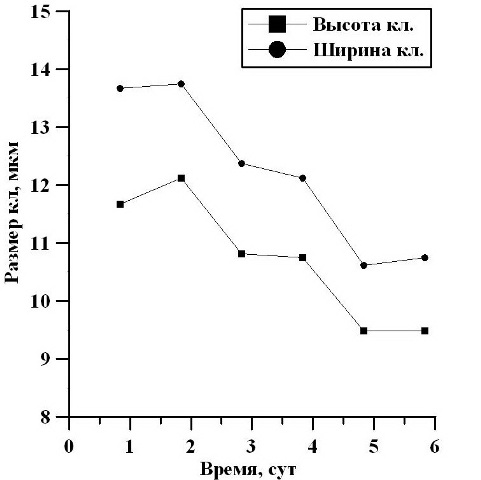
На протяжении экспоненциальной фазы роста (2-6 сутки) средние размеры клеток уменьшались: в высоту от 13,67 мкм до 10,75 мкм, то есть в 1,3 раза, а в ширину от 11,67 мкм до 9,48 мкм, в 1,2 раза (рис. 4).
Рис. 4. Изменение высоты и ширины клеток в экспоненциальной фазе роста. Fig. 4. Changes in the height and width of the cells in the exponential growth phase.
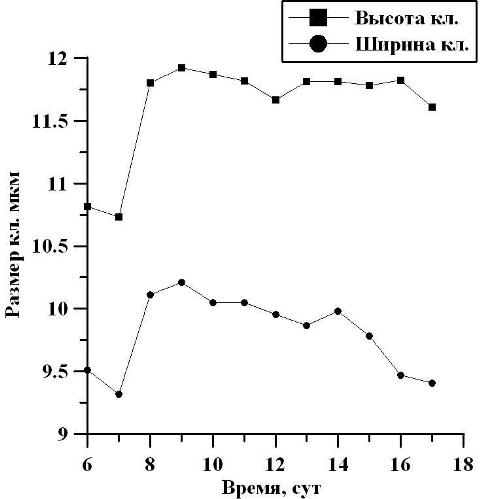
По достижении культурой линейной фазы, первые двое суток отмечался рост среднего размера клеток: в высоту от 10,75 до 11,80 мкм, а в ширину от 9,48 до 10,11 мкм, то есть в 1,1 раза (рис. 5). В течение последующих суток на линейном участке средний размер высоты клеток находился на одном и том же уровне, и составил 11,79 мкм. Средняя же ширина клеток на линейном участке уменьшалась от 10,11 до 9,41 мкм, то есть в 1,1 раза. В целом, средний размер клеток на линейном участке (6-17 сутки) в высоту составил 11,62 мкм, а в ширину – 9,81 мкм.
Рис. 5. Изменение высоты и ширины клеток в линейной фазе роста. Fig. 5. Change the height and width of the cells in the linear growth phase.
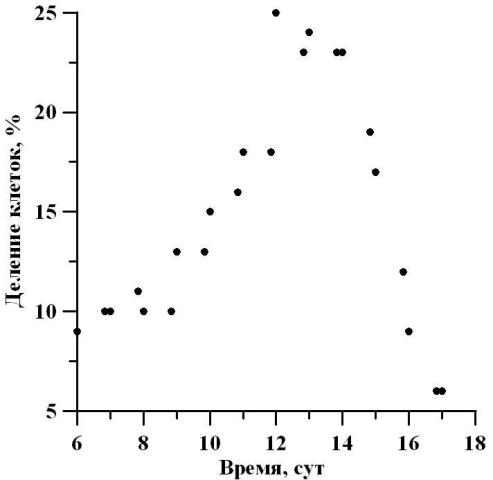
Измерение морфометрических параметров D. viridis показало, что на протяжении экспоненциальной фазы роста размеры клеток уменьшаются. В начале экспоненциальной фазы роста культура отличалась высоким содержанием клеток высотой 13 мкм (32%) и шириной 11 мкм (38%), а в конце этой фазы преобладали клетки с размерами 9,5 мкм (42%) и 8 мкм (34%) соответственно. Следовательно, высота клеток уменьшилась в 1,3 раза, а ширина в 1,4 раза. Подобное увеличение процентного содержания клеток с малыми размерами свидетельствует об изменении индивидуального возраста клеток с преобладающим содержанием «молодых», еще находящихся в стадии роста. На линейном участке отмечается высокое содержание клеток высотой 11 мкм, число которых варьирует от 36 до 47%. При этом наибольший процент в начале линейной фазы составили клетки шириной 9,5 мкм (56%), а в конце этой фазы – 8 мкм (39%). Таким образом, ширина клеток уменьшилась в 1,2 раза, в то время как длина клеток осталась неизменной. На протяжении линейной фазы роста отмечалось изменение физиологического состояния популяции (рис. 6). Так, в начале и в конце линейного участка общее количество клеток, находящихся в стадии митоза, составило 10 и 6% соответственно. По мере роста культуры и перехода ее в стационарную фазу доля делящихся клеток в ней уменьшается. Это связано как с затенением культуры, так и накоплением метаболитов в среде. Максимальный процент делящихся клеток составил 25% на 12 сутки культивирования. Следовательно, с начала линейной фазы содержание делящихся клеток увеличилось в 2,5 раза, а достигнув середины линейного участка, уменьшилось в 4,2 раза. Можно отметить, что увеличение процентного содержания делящихся клеток может быть связано с изменением продуктивности, также увеличивающейся в середине линейного участка фазы роста (рис. 6).
Рис. 6. Динамика процентного содержания делящихся клеток D. viridis в линейной фазе роста. Fig. 6. Dynamics of the percentage of dividing cells D. viridis in the linear growth phase.
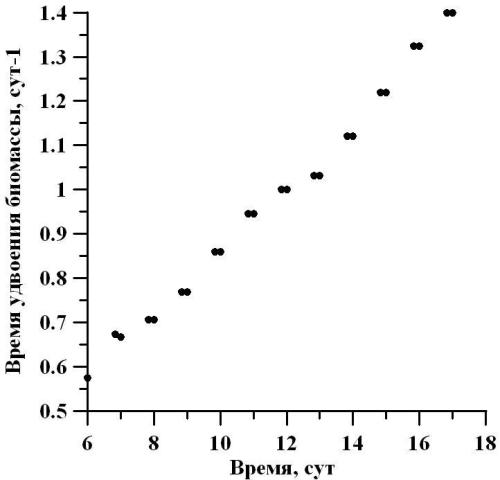
По мере роста плотности культуры, удельная скорость роста, которая не зависит от массы и объёма, уменьшается обратно пропорционально плотности (Тренкеншу, Щепачев, 2010; Хайлов, 1971). Рассчитывая время генерации от удельной скорости роста на линейном участке, можно отметить монотонное увеличение времени между делениями в сутки. Так, в начале линейного участка время генерации составляло 0,6 сут-1, а в конце – 1,4 сут-1 (рис. 7).
Рис. 7. Динамика количества делений в сутки D. viridis в линейной фазе роста. Fig. 7. Dynamics of the number of divisions per day D. viridis in the linear growth phase.
Заключение Исследование Dunaliella viridis при накопительном культивировании в условиях непрерывного освещения показало, что максимального значения (1,2 г/л АСВ) биомасса достигла на 23 сутки эксперимента, а численность клеток (229,5·104 кл/мл) – на 20 сутки. Выявлено, что на протяжении линейной фазы роста средняя высота клеток оставалась неизменной, а ширина уменьшилась в 1,1 раза. Определено, что содержание клеток с максимальной высотой не изменилось, а с максимальной шириной – уменьшилось в 1,2 раза к концу линейной фазы. Определено, что максимальный процент делящихся клеток на линейном участке составил 25%.
Список литературы 1. Боровков А.Б. Динамика пигментов и роста морских микроводорослей в хемостате на примере Dunaliella salina Teod.: Автореф. дис. канд. биол. наук. – Севастополь, 2008. – 31 с. 2. Боровков А.Б. Зеленая микроводоросль Dunaliella salina Teod. (обзор) // Экология моря. Вып. 67. 2005. С. 5–17. 3. Масюк Н.П. Морфология, систематика, экология, географическое распространение рода Dunaliella Teod. – Киев: Наукова думка, 1973. – 487 с. 4. Масюк Н.П., Посудин Ю.И., Лилицкая Г.Г. Фотодвижение клеток Dunaliella Teod. (Dunaliellales, Chlorophyceae, Viridiplantae) – Киев: Академ-периодика, 2007. – 264 с. 5. Сиренко Л.А. Методы физиолого-биохимического исследования водорослей в гидробиологической практике. – Киев: Наукова думка, 1975. – 247 с. 6. Тренкеншу Р.П., Боровков А.Б., Лелеков А.С. Унифицированная лабораторная установка для исследования низших фототрофов. – Севастополь: Изд-во ИнБЮМ НАНУ, 2009. – 41 с. 7. Тренкеншу Р.П. Простейшие модели роста микроводорослей. 1. Периодическая культура // Экология моря. 2005. Вып.67. С. 89–97. 8. Тренкеншу Р.П. Ростовые и фотоэнергетические характеристики морских микроводорослей в плотной культуре: автореф. дисс. канд. биол. наук. – Красноярск, 1984. – 28 с. 9. Тренкеншу Р.П., Щепачев С.Г. Простейшие модели роста микроводорослей. 8. Индивидуальный рост клеток в хемостате // Экология моря. 2010. №81. С. 66–70. 10. Хайлов К.М. Экологическая физиология морских планктонных водорослей (в условиях культур). – Киев: Наук. думка, 1971 – 208 с. 11. Ben-Amotz A., Shaish A., Avron M. Mode of action of the massively accumulated, β-carotene of Dunaliella bardawil in protecting the alga against damage by excess irradiation // Plant Physiol. 1989. Vol.91, №3. P. 1040–1043. 12. Tran D., Louime C., Võ T., Giordano M., Portilla S., Doan N., Tran D., Mai T., Bui L. Identification of Dunaliella viridis using its markers // International journal of applied science and technology. 2013. Vol.3, №4. P. 118–126. Статья поступила в редакцию 20.12.2016
Morphometric characteristic of cells microalgae Dunaliella viridis in batch culture Olga A. Maltceva Morphological parameters of Dunaliella viridis have been studied during in batch culture under continuous illumination. The maximum values of biomass and the number of cells have been determined and the dynamics of their relationship. It was found that during the linear growth phase, the average height of the cells and the percentage of cells with a maximum height remains unchanged, and the average width of the cells and of cells with a maximum width decreases of 1.1 and 1.2 times respectively. It was noted, the maximum percentage of dividing cells was 25%. Key words: Dunaliella viridis; biomass; number of cells; height and width of cells; division; quantity batch cultivation; continuous lighting.
Об авторе Мальцева Ольга Александровна - Maltceva Olga A. ведущий инженер, Институт морских биологических исследований им.А.О.Ковалевского РАН (ФГБУН ИМБИ), г. Севастополь, Россия (Federal State Institution of Science «The A. O. Kovalevsky Institute of Marine Biological Research of RAS» IMBR, Sevastopol, Russia), Отдел биотехнологий и фиторесурсов maltsevaolya@bk.ru Корреспондентский адрес: Севастополь 299011, проспект Нахимова, 2; тел. (869)-2550795.
ССЫЛКА НА СТАТЬЮ: Мальцева О.А. Морфометрические характеристики клеток микроводоросли Dunaliella viridis в накопительной культуре // Вопросы современной альгологии. 2017. № 1 (13). URL: http://algology.ru/1137 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||