 |
Исследования особенностей морфогенеза у различных видов рода Micrasterias C.Agardh ex Ralfs (Conjugatophyceae)
Study of the morphogenesis peculiarities in different species from the genus Micrasterias C. Agardh ex Ralfs (Conjugatophyceae)
Неретина А.Н.
Anna N. Neretina
Московский Государственный Университет имени М.В. Ломоносова,
биологический факультет, кафедра микологии и альгологии
УДК 581.4
Обзор посвящен морфогенезу десмидиевых водорослей рода Micrasterias C. Agardh ex Ralfs, который в последнее время привлекает внимание как альгологов, так и специалистов в области клеточной биологии, физиологии растений, биофизики. Освещена история изучения морфогенеза у Micrasterias, выдвигавшиеся ранее гипотезы для объяснения изменений в его ходе, последние результаты, связанные с использованием электронной микроскопии. Особое внимание уделено физиологическим аспектам процессов морфогенеза у различных представителей рода и его математическому моделированию. Следует признать, что, несмотря на многолетнюю историю изучения морфогенеза у десмидиевых водорослей, остается еще много вопросов, ожидающих своего решения. Однозначно можно сказать только то, что морфогенез – процесс сложный, в него вовлечено большое количество субклеточных структур и, возможно, различных генов.
Ключевые слова: Conjugatophyceae; Desmidiales; водоросли; морфогенез.
Введение
Плакодермные десмидиевые имеют клетки, состоящие из двух симметричных половинок – полуклеток, соединенных между собой узким перешейком (Akin, Meyer, 1996). Во время вегетативного деления две полуклетки отделяются друг от друга при помощи септы (Lacalli, 1973). При этом исходная интерфазная симметрия нарушается. В дальнейшем происходит постепенный рост дочерней полуклетки и восстановление исходной симметрии.
Уже несколько десятков лет процессы формирования дочерних полуклеток и восстановление исходной интерфазной симметрии у десмидиевых водорослей привлекают внимание как альгологов, так и специалистов в области клеточной биологии, физиологии растений, биофизики.
Многие наблюдения за морфогенезом у десмидиевых выполнены на уровне световой микроскопии, однако детальное исследование морфогенеза при помощи методов электронной микроскопии проведено лишь для незначительного количества родов десмидиевых водорослей: Staurastrum (Pickett-Heaps, 1974; Vidyavati, 1982), Cosmarium (Pickett-Heaps, 1974; Vidyavati, Sathaiah, 1984) и Micrasterias (Pickett-Heaps, 1974; Meindl et al., 1992).
Большинство работ по исследованию механизмов морфогенеза выполнено на различных видах рода Micrasterias. Это обусловлено тем, что:
1) многие виды Micrasterias имеют достаточно крупные клетки, что упрощает наблюдения за различными стадиями морфогенеза и облегчает манипуляции, производимые с клетками в ходе экспериментов, например, при введении микроэлектродов для регистрации токов ионов кальция (Troxell, Scheffey, 1991);
2) культуры клеток Micrasterias хорошо растут в лабораторных условиях (Kallio, Heikkilä, 1969);
3) имеется большое количество мутантных штаммов, выделенных из природы и полученных в лабораторных условиях при действии химических (Tippit, et al, 1982) или физических мутагенов (Lacalli, 1976). Это дает возможность изучать влияние плоидности ядра на симметрию клетки (Lacalli, 1976), а также роль ядра в реконструкции исходной симметрии (Selman, 1966; Kallio, Heikkilä , 1969; Pihakaski, Kallio, 1978; Tippit et al., 1982).
4) Бирадиальные клетки Micrasterias имеют двояковыпуклую форму и при моделировании возможно рассмотрение процессов морфогенеза в двухмерном, а не в трехмерном пространстве, что значительно упрощает получаемую математическую модель (Holloway, Harrison, 1999).
1. История изучения процессов морфогенеза у Micrasterias
Род Micrasterias был описан еще в начале XIX века шведским исследователем Эгердом (Agardh, 1827, цит. по: Meindl, 1993), но ошибочно отнесен к семейству Ulvaceae. Лишь в 1848 г Дж. Ральфс сделал детальное морфологическое описание Micrasterias в работе «Британские десмидиевые» (Ralfs, 1848, цит. по: Meindl, 1993). В конце XIX – начале XX веков были выполнены первые описания процессов деления и реконструкции формы клеток у десмидиевых водорослей на уровне световой микроскопии (Hauptfleisch, 1888; Lütkemüller, 1902, цит.по: Meindl, 1993).
Введение специальных сред для культивирования десмидиевых в XX веке (Pringsheim, Waris, цит. по: Meindl, 1993) позволило провести первые экспериментальные исследования физиологических процессов, происходящих при морфогенезе. В частности, было установлено влияние на морфогенез Micrasterias сред с различной осмолярностью (Meindl et al., 1989).
Большие успехи в изучении морфогенеза у Micrasterias были достигнуты при помощи методов электронной микроскопии. Разработка специальной процедуры химической фиксации клеток для трансмиссионной электронной микроскопии (ТЭМ) позволила пронаблюдать за изменениями, происходящими на различных стадиях морфогенеза (Kiermayer , 1968; Meindl, 1993). Наблюдения, полученные при использовании химической фиксации, были дополнены сведениями, полученными при использовании методов замораживания-скалывания (Kiermayer, Sleytr, 1979) и замораживания-замещения (Meindl et al., 1992).
На основе наблюдений, выполненные на уровне световой и электронной микроскопии, были постулированы две гипотезы морфогенеза:
1) Цитоплазматическое определение формы дочерней полуклетки. В цитоплазме присутствует сеть фибрилл («cytoplasmic fibrils»), направленная от материнской полуклетки к главной и основным боковым лопастям дочерней полуклетки (Waris, цит. по: Meindl, 1993). Таким образом, в процессах морфогенеза основная роль отводится элементам цитоскелета.
2) В определении формы дочерней полуклетки большую роль играют специальные участки плазматической мембраны дочерней полуклетки, с которыми преимущественно сливаются вакуоли, содержащие материал первичной клеточной стенки (Kiermayer, цит. по: Meindl, 1993).
На данный момент ясно, что морфогенез клеток десмидиевых – очень сложный процесс, в который вовлечены многие субклеточные структуры, поэтому перечисленные выше гипотезы могут быть объединены.
2. Качественные наблюдения морфогенеза у десмидиевых водорослей на уровне световой и электронной микроскопии
Интерфазные клетки Micrasterias, подобно клеткам других плакодермных десмидиевых, состоят из двух симметричных полуклеток, соединенных между собой узким перешейком (рис. 1). Каждая полностью сформированная полуклетка Micrasterias имеет одну полярную лопасть и боковые лопасти. Интерфазная клетка Micrasterias содержит два хлоропласта (по одному на каждую полуклетку) и достаточно крупное ядро, локализованное в области перешейка (Meindl, 1993). Полярная лопасть всегда отличается по форме от боковых лопастей. В зависимости от вида у Micrasterias может быть две боковые неветвящиеся лопасти (M. arcuata), однократно ветвящиеся (M. pinnatifida), двукратно (M. decemdentata), трехкратно (M. radiata), четырехкратно (M. papillifera), пятикратно (M. apiculata) или шестикратно (M. radiosa) ветвящиеся боковые лопасти (McNally, 1990). Однако несмотря на достаточно большое разнообразие формы интерфазных клеток у разных видов рода Micrasterias, начальные этапы морфогенеза после митотического деления у всех видов сходны (рис. 1, 2).
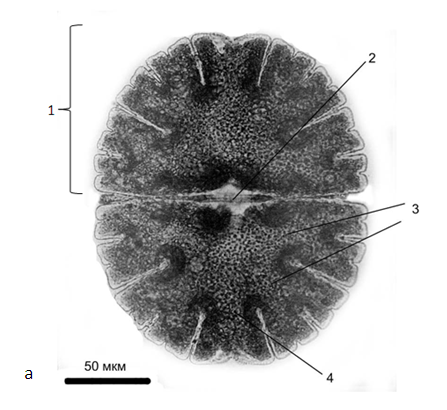
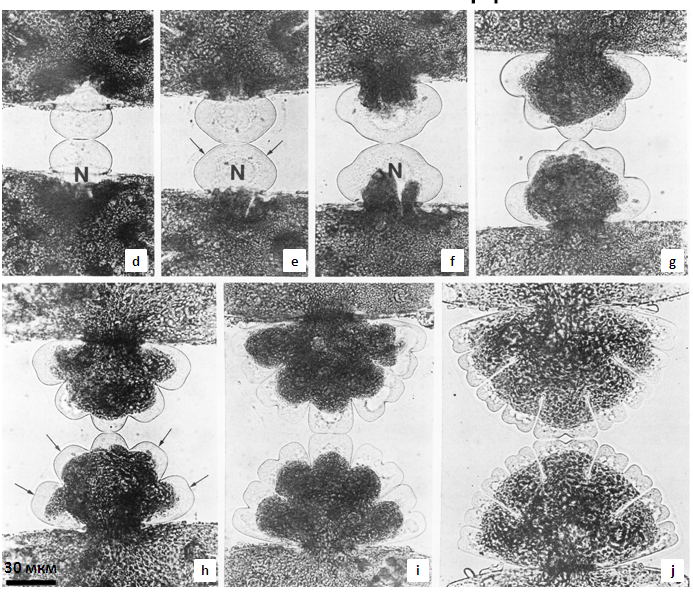
Рис. 1. Micrasterias denticulata:
а - общий вид полностью сформированной клетки:
1- полуклетка; 2 - перешеек; 3 - главные боковые лопасти; 4 - полярная лопасть.
d-j – последовательные стадии реконструкции формы материнской полуклетки у дочерней
(с изменениями, по Meindl, 1993).
В среднем митотические деления в культуре у разных видов Micrasterias происходят каждые 3-4 дня (Meindl, 1993). Частота митотических делений зависит от состояния культуры. Для Micrasterias thomasiana var. notata показано, что при наилучших условиях культивирования время генерации составляет 3 дня, а случае, если требуется обновление культуральной среды, время генерации может составлять 5 и более дней (Selman, 1966). Максимальная частота митотических делений у Micrasterias, как и у многих других десмидиевых водорослей, приходится на темное время суток (Brandham, 1965).
Во время цитокинеза область перешейка удлиняется, при этом происходит частичное отслоение вторичной клеточной стенки и образование воротничка в области перешейка, затем центрипетально откладывается материала септы, состоящий, преимущественно, из пектинов (Lacalli, 1973). Возможно, образовавшаяся септа может играть роль «шаблона» для дальнейших этапов морфогенеза (Kiermayer, цит. по: Lacalli, 1973).
Как только две полуклетки оказываются разделенными при помощи септы, начинается активное отложение материала первичной клеточной стенки в области септы, на каждой из двух старых полуклеток возникает по бугорку (рис. 1d; 2b). Сначала наблюдается равномерный рост бугорков, но приблизительно через 75 мин (для M.denticulata) два участка клеточной периферии прекращают свой рост. Образуется хорошо заметные лопасти (рис. 1e, f; 2с). В дальнейшем происходит дихотомическое ветвление лопастей. В результате полностью восстанавливается исходная форма клетки, характерная для каждого из видов.
Рис.2. Micrasterias thomasiana:
a – общий вид полностью сформированной клетки; b-f - последовательные стадии реконструкции формы материнской полуклетки у дочерней (a – f: Х 259) (по McNally, 1990).
В морфогенезе активное участие принимают различные субклеточные структуры. При помощи трансмиссионной электронной микроскопии обнаружено, что на периферии дочерних полуклеток в местах активного роста кончиков лопастей наблюдается большое скопление везикул с электронно плотным содержимым (dark vesicles - DVs), производных аппарата Гольджи (Meindl et al., 1992; Meindl, 1993). DVs содержат пектины и участвуют в отложении материала первичной клеточной стенки (Menge, 1976; цит.по: Meindl et al., 1992), причем на кончиках лопастей DVs расположены строго упорядоченно (рис.3). На стадии формирования лопастей как в дочерней, так и в материнской полуклетках наблюдается большое количество диктиосом, в которых происходит сборка полисахаридов клеточной стенки (Meindl et al., 1992). К кончикам растущих лопастей везикулы с материалом первичной клеточной стенки доставляются по системе микротрубочек. Действие веществ, блокирующих сборку элементов цитоскелета, приводит к нарушению процессов морфогенеза (Tippit, Pickett-Heaps, 1974).
Формирование первичной клеточной стенки у M. denticulata занимает около 4,5 часов (Meindl, 1993). Пектины первичной клеточной стенки достаточно хорошо растворимы в воде. Возможно, наружный слизистый слой, в состав полисахаридов которого входит значительное количество дезоксисахаров (фукозы и ксилозы), придающих некоторую гидрофобность слизи (Kiemle et al., 2007), частично защищает первичную клеточную стенку от растворения в воде.
После завершения процессов отложения первичной клеточной стенки наблюдается отделение от цистерн аппарата Гольджи везикул (flat vesicles - FVs), в мембраны которых встроены целлюлозосинтазные комплексы. После слияния везикул с плазматической мембраной за счет работы целлюлозосинтазных комплексов происходит синтез микрофибрилл целлюлозы и образование жесткой вторичной клеточной стенки (Kiermayer, Sleytr, 1979; Schmid, Meindl, 1992).
Во время отложения вторичной клеточной стенки от аппарата Гольджи отделяются еще один тип везикул (pore vesicles - PVs). Предположительно PVs содержат слизь. В местах их слияния с цитоплазматической мембраной клетки формирования вторичной клеточной стенки не происходит. Так образуются поры во вторичной клеточной стенке (Meindl et al., 1992).
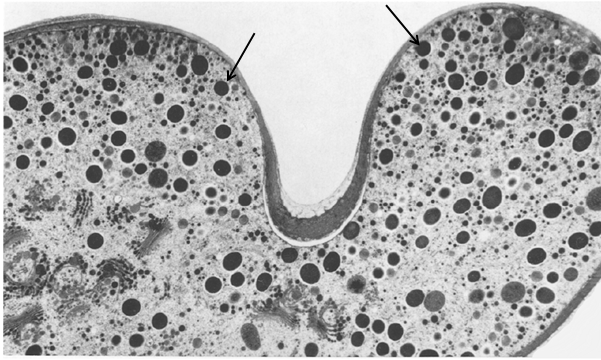
Рис.3. Лопасть Micrasterias denticulata на стадии формирования первичной клеточной стенки.
DVs обозначены стрелками. Х 9,000 (по Meindl et al., 1992).
На следующем этапе морфогенеза с участками цитоплазматической мембраны наблюдается слияние больших везикул (LVs – large vesicles), отшнуровывающихся от аппарата Гольджи, и также содержащих слизь. Обильная секреция слизи через поры приводит к отделению первичной клеточной стенки от вторичной и последующему ее сбрасыванию – процессу линьки. После отделения первичной клеточной стенки происходит расхождение двух полностью сформированных клеток Micrasterias и процесс морфогенеза завершается (Meindl et al., 1992). Через некоторое время отделившаяся первичная клеточная стенка растворяется.
3. Физиологические аспекты процессов морфогенеза у Micrasterias
Качественное описание процессов морфогенеза на уровне световой и электронной микроскопии не позволяет ответить на многие вопросы. Работы на мутантных штаммах (Lacalli, 1976; Tippit et al., 1982), эксперименты по изучению ядерного контроля морфогенеза (Selman, 1966; Kallio, Heikkilä, 1969; Pihakaski, Kallio, 1978) и влиянию условий окружающей среды (Meindl et al., 1989) позволили выяснить некоторые, но далеко не все, физиологические аспекты основных этапов морфогенеза у Micrasterias.
В многочисленных экспериментах по изучению ядерного контроля морфогенеза у Micrasterias установлено, что первые стадии, протекающие одинаково у разных видов рода Micrasterias, могут идти в клетках, лишенных ядер в результате облучения ультрафиолетом или при центрифугировании. Это подтверждает утверждение Киермеера о том, что плазматическая мембрана в области отложения септы играет важную роль в начальных этапах морфогенеза (Kiermayer, цит. по: Lacalli, 1973).
У полностью сформированной полуклетки морфология полярной лопасти сильно отличается от морфологии боковых лопастей по характеру ветвления. Известны мутанты у M. thomasiana, полученные при действии на культуру клеток этил-метан сульфоната (EMS), лишенные полярной лопасти (рис.4). Это может свидетельствовать о том, что образование боковых и полярных лопастей находится под контролем разных генов (Tippit et al., 1982).

Рис.4. Micrasterias thomasiana:
1 - нормальная клетка. Х 269;
2 - клетка, полученная при воздействии EMS. Х 356 (с изменениями, по Tippit et al., 1982).
Действие веществ, блокирующих работу рибосом и синтез белков (Tippit, Pickett-Heaps, 1974), приводит к нарушению процессов морфогенеза, хотя у таких клеток происходит образование первых трех лопастей (двух боковых и одной полярной). Это может свидетельствовать о том, что специфическая форма лопастей и их ветвление, характерное для каждого из видов рода Micrasterias, находятся под контролем ядра.
Выяснено, что в морфогенезе у Micrasterias важную роль играют актиновые микрофиламенты, координирующие токи цитоплазмы. Наибольшее количество актиновых микрофиламентов наблюдается на кончиках растущих лопастей. Также имеются актиновые микрофиламенты, протянутые от лопастей материнской полуклетки к дочерней полуклетке (предполагают, что они могут быть закреплены на поверхности цитоплазматической мембраны при помощи специальных белков). Разрушение актиновых микрофиламентов при использовании цитохалазина В останавливает процессы развития дочерней полуклетки (Ueda, Noguchi, 1988 цит. по: Holloway, Harrison, 1999).
Замечено, что на морфогенез у Micrasterias существенное влияние оказывает осмолярность культуральной среды (Meindl et al., 1989), а также содержание ионов Ca2+ в среде (Meindl, 1982; Troxell, Scheffey, 1990; Meindl, 1993).
При помощи использования микроэлектродов были зарегистрированы входящие токи Ca2+ на кончиках роста лопастей дочерней полуклетки (Troxell, Scheffey, 1990).
В точках роста на кончиках лопастей происходит аккумуляция ионов Ca2+ у внутренней поверхности клеточной мембраны (Meindl, 1993). Катионы кальция поступают из внешней среды через специальные ионные каналы. Поскольку десмидиевые водоросли обычно встречаются в олиготрофных водоемах, где содержание минеральных солей не велико (Vidyavati, 1985), то возможно, что сульфатированные анионные полисахариды наружного слизистого слоя (Kiemle et al., 2007) играют роль депо для различных катионов, в том числе и для катионов кальция.
Наружная сторона плазматической мембраны клетки Micrasterias, подобно мембране любой растительной клетки, заряжена положительно, а внутренняя – отрицательно за счет работы Н+-АТФазы плазмалеммы (Физиология растений, 2005).
Проникая в клетку через специальные каналы по градиенту концентрации, катионы кальция снимают отрицательный заряд с внутренней стороны плазматической мембраны, на мембране образуется локальный положительный заряд, что позволяет различным везикулам, наружная мембрана которых заряжена отрицательно за счет работы Н+-АТФазы V-типа (Физиология растений, 2005), сливаться с плазматической мембраной в строго определенных местах, тем самым способствуя упорядоченному ветвлению лопастей (при отложении материала первичной клеточной стенки) (Troxell, Scheffey, 1990) или упорядоченному расположению пор (при слиянии PVs с плазматической мембраной) (Meindl, 1982). Предложенный механизм слияния везикул с плазматической мембраной обуславливает их строго упорядоченное расположение у поверхности цитоплазматической мембраны на кончиках роста лопастей, наблюдаемое при использовании метода замораживания-замещения (рис. 3).
Однако не ясно, почему происходит дихотомическое ветвление лопастей на кончиках и почему полярная лопасть отличается по морфологии от боковых лопастей.
Конечно, можно предположить, что в боковых лопастях и главной лопасти находятся группы различных кальциевых каналов, кодируемых разными генами и отличающимися, например, по сродству к катионам кальция. При этом остаются непонятными механизмы, при помощи которых обеспечивается строгая пространственная локализация каналов на мембране растущей дочерней полуклетки.
4. Математическое моделирование процессов морфогенеза у разных видов рода Micrasterias
При морфогенезе у Micrasterias происходит перенос различных структур. Подобно любой биологической системе формирующаяся дочерняя полуклетка представляет собой активную кинетическую среду, в которой действуют процессы диффузии (перемещение структур под действием случайных сил) и взаимодействия между компонентами системы в каждой отдельной точке пространства (т.е. реакция между компонентами). Многие процессы развития биологических систем могут быть описаны при помощи модели реакция-диффузия и различных ее модификаций, в частности при помощи модели Тьюринга, в которой рассматриваются процессы реакции – диффузии между двумя морфогенами (Holloway, Harrison, 1999).
В настоящее время разработано достаточно много моделей морфогенеза у разных видов Micrasterias, основанных на брюсселяторе Пригожина-Лефевра (Holloway, Harrison, 1999). Изменение параметров в используемых дифференциальных уравнениях позволяет с достаточно большой степенью точности моделировать морфогенез у разных видов, однако параметры используемой модели трудно интерпретируемы в рамках качественного описания процессов морфогенеза. На основе одной из таких моделей (Holloway, Harrison, 1999) постулировано существование некоторого мембранного белка, связанного с процессом слияния везикул с цитоплазматической мембраной. Этот мембранный белок может находиться в двух состояниях – фосфорилированном и дефосфорилированном. Возможно, фосфорилирование белка приводит к его активации в результате которой происходит транспорт катионов кальция внутрь клетки.
Математические модели, построенные на основе использования брюсселятора, не имеют решений в явном виде. Для того, чтобы облегчить изучение таких моделей, по возможности стараются упрощать происходящие процессы и уменьшать размерность пространства. Поэтому рассмотрение таких моделей не позволяет понять явления, происходящие в цитоплазме клеток и приводящие к формированию дихотомически ветвящихся ростовых зон (Meindl, 1993).
Заключение
Несмотря на многолетнюю историю изучения морфогенеза у десмидиевых водорослей, остается еще много вопросов, ожидающих своего решения. Однозначно можно сказать только то, что морфогенез – процесс сложный, в него вовлечено большое количество субклеточных структур и, возможно, различных генов. На процессы морфогенеза большое влияние оказывают условия внешней среды, во многом определяющие физиологическое состояние клеток. В неблагоприятных для данного вида условиях возможно нарушении процессов морфогенеза и образование клеток, сильно отличающихся по морфологии (форме, орнаментации, симметрии и другим признакам) от тех клеток, которые развивались в благоприятных условиях. Подверженность морфологических признаков различным изменениям под действием факторов окружающей среды необходимо учитывать при идентификации десмидиевых, описании новых видов и разновидностей, а также при подборе условий для лабораторного культивирования, так как у многих десмидиевых при росте в культуре наблюдается значительное изменение морфологических признаков (Ling, Tyler, 1972).
Благодарности
Выражаю искреннюю благодарность научному руководителю Ольге Викторовне Анисимовой.
Список литературы
1. Физиология растений/ под ред. И.П. Ермакова. М: Академия, 2005, 640 с.
2. Akin J.A., Meyer R.L. Examination of the cell wall of Micrasterias radiosa var. radiosa (Conjugatophyceae) by transmission and scanning electron microscopy // Proceedings Arkansas Academy of Science. 1996. 50. P. 17-21.
3. Brandham P. E. Some new chromosome counts in the desmids // Br. Phycol. Bull. 1965. 2 (6). P. 451-455.
4. Holloway D.M., Harrison L.G. Algal morphogenesis: modeling interspecific variation in Micrasterias with reaction-diffusion patterned catalysis of cell surface growth // Phis. Trans.R.Soc.Lond. 1999. B. 354. P. 417-433.
5. Kallio P., Heikkilä H. UV-induced facies change in Micrasterias torreyi // Österr. Bott.Z. 1969. 116. P. 226-243.
6. Kiemle S.N., Domozych, Gretz R. The extracellular polymeric substances in desmids (Conjugatophyceae, Streptophyta): chemistry, structural analyses and implications in wetland biofilms // Phycologia. 2007. 46 (6). P. 617-627.
7. Kiermayer O. The distribution of microtubules in differentiating cells of Micrasterias denticulate Breb // Planta (Berl.). 1968. 83. P. 223-236.
8. Kiermayer O., Sleytr U.B. Hexagonally ordered “rosettes” of particles in the plasma membrane of Micrasterias denticulate Breb. and their significance for microfibril formation and orientation // Protoplasma. 1979. 101. P. 133-138.
9. Lacalli T.C. Cytokinesis in Micrasterias rotata. Problems of directed primary wall deposition // Protoplasma. 1973. 78. P. 433-442.
10. Lacalli T.C. Morphogenesis in Micrasterias. The morphogenetic template // Protoplasma. 1976. 88. P. 133-146.
11. Ling H.U., Tyler P.A. The process and morphology of conjugation in desmids, especially the genus Pleurotaenium // British phycology J. 1972. 7. P.65-79.
12. McNally J.G. Scale-Invariant pattern in the alga Micrasterias // Journal of Biological physics. 1990. 17. P. 235-243.
13. Meindl U. Patterned distribution of Membrane-associated Ca2+ during pore formation in Micrasterias // Protoplasma. 1982. 112. P. 138-141.
14. Meindl U. Micrasterias cells as a model system for research on morphogenesis // Microbiological reviews. 1993. 57 (2). P. 415-433.
15. Meindl U., Lancelle S., Hepler P.K. Vesicle production and fusion during lobe formation in Micrasterias visualized by high-pressure freeze fixation // Protoplasma. 1992. 170. P.104-114.
16. Meindl U., Wittmann-Pinegger, Kiermayer O. Cell multiplication and ultrastructure of Micrasterias denticulate (Desmidiaceae) grown under salt stress // Pl. Syst. Evol. 1989. 164. P. 197-208.
17. Pickett-Heaps J.D. Scanning electron microscopy of some cultured desmids // Transactions of the American Microscopical Society J. 1974. 93. P. 1-23.
18. Pihakaski K., Kallio P. Effect of denucleation and UV-irradiation on the subcellular morphology in Micrasterias // Protoplasma. 1978. 95. P. 37-55.
19. Schmid V.H.R., Meindl U. Microtubules do not control orientation of secondary cell wall microfibril deposition in Micrasterias // Protoplasma. 1992. 169. P. 148-154.
20. Selman G.G. Experimental evidence for the nuclear control of differentiation in Micrasterias // J. Embryol. Exp. Morph. 1966. 16, 3. P. 469-485.
21. Tippit D. H., Pickett-Heaps J.D. Experimental investigations into morphogenesis in Micrasterias // Protoplasma. 1974. 81. P. 271-296.
22. Tippit D.H., Smith H., Pickett-Heaps J.D. Cell form mutants in Micrasterias // Protoplasma. 1982. 113. P. 234-236.
23. Troxell C.L., Scheffey C. Ionic currents flow through Micrasterias and Closterium cells during expansion of the primary cell wall // Planta. 1991. 184. P. 218-225.
24. Vidyavati. Cell division in Staurastrum gracile Ralfs under the scanning electron microscope // Proc. Indian Acad. Sci. (Plant. Sci.). 1982. 91 (5). P. 443-447.
25. Vidyavati. Environmental control of cell morphology in desmids // Proc. Indian. Acad.Sci. (Plant Sci.). 1985. 95. P. 193-198.
26. Vidyavati, Sathaiah G. Cosmarium botrytis Menegh. Under scanning electron microscope // Proc. Indian Acad. Sci. (Plant. Sci.). 1984. 93 (4). P. 459-465.
опубликовано - июнь 2012 г.
Study of the morphogenesis peculiarities in different species
from the genus Micrasterias C. Agardh ex Ralfs (Conjugatophyceae)
Anna N. Neretina
This review concerns the morphogenesis in desmid algae of the genus Micrasterias C. Agardh ex Ralfs, which recently attracts the attention of algologists, as well as the specialists in cell biology, plant physiology and biophysics. The history of the morphogenesis studies in Micrasterias, earlier proposed hypotheses for the explanation of changes in course of the morphogenesis, and last progress due to applying of the electron microscope, are discussed. A special attention is paid to the physiological aspects of the morphogenesis in different taxa of this genus and to its mathematical modeling. We need to conclude that despite the long history of studies, still there are many questions concern the morphogenesis in the desmids. Definitively it could be concluded that the morphogenesis is a complicated process, with many sub-cellular structures, and probably genes, involved.
Key words: Conjugatophyceae; Desmidiales; algae; morphogenesis.
Об авторе
Неретина Анна Николаевна - Neretina Anna Nikolaevna
студент
ФГБОУ ВПО «Московский государственный университет им.М.В.Ломоносова», Москва, Россия (Lomonosov Moscow State University, Moscow, Russia), Биологический ф-т, каф. микологии и альгологии
neretina-anna@yandex.ru
Корреспондентский адрес: Россия, 119991, Москва, Ленинские горы, Московский Государственный Университет им.М.В.Ломоносова, д. 1, стр. 12, Биологический ф-т, каф. микологии и альгологии; тел.: (495) 939-54-82
ССЫЛКА НА СТАТЬЮ:
Неретина А.Н. Исследования особенностей морфогенеза у различных видов рода Micrasterias C.Agardh ex Ralfs (Conjugatophyceae) // Вопросы современной альгологии. 2012. № 1 (1). URL: http://algology.ru/99
Карта сайта

|
 |
|

