|
|
|
Видовое разнообразие и структура фитопланктона в проливе Великая Салма (Кандалакшский залив, Белое море) в 2021 году
Резник Е.В., Георгиев А.А. Evgenia V. Reznik, Anton A. Georgiev
Московский Государственный Университет имени М.В. Ломоносова,
УДК 574.52
Видовой состав и структура сообщества фитопланктона в проливе Великая Салма (Кандалакшский залив, Белое море) были изучены в период с мая по сентябрь 2021 года. Всего было выявлено 128 таксонов микроводорослей. Наибольшим числом видов были представлены диатомовые водоросли (на их долю приходилось 80% от общего разнообразия), доля динофитовых составила 15%, цианобактерий – 3%, охрофитовых и церкозой – по 1%. Численность фитопланктона варьировала от 1,84 х 106 кл./м3 (в августе) до 23,27 х 106 кл./м3 (в июле), биомасса фитопланктона варьировала от 31,4 мг/м3 (в мае) до 246,7 мг/м3 (в июле). Доминирующие (как по численности, так и биомассе) виды были представлены в основном диатомовыми водорослями, из динофитовых водорослей один вид, Sсrippsiella acuminata, также входил в состав доминантов по численности. Ключевые слова: фитопланктон; ББС МГУ; Белое море; Россия; таксономическое разнообразие; биомасса; численность
Фитопланктон является основой морских пищевых цепей, по нему можно судить о состоянии всей экосистемы. Среди северных морей России Белое море выделяется достаточно высоким видовым разнообразием фитопланктона. Согласно литературным данным, в Белом море обитает более 300 видов планктонных водорослей. Из них наиболее распространены представители Bacillariophyta, следующая по числу видов группа – Dinophyta (Okolodkov, 1998; Ильяш и др., 2003; Гогорев, 2005; Vershinin et al., 2006; Радченко и др., 2022). Несмотря на важность изучения морского фитопланктона, последнее детальное исследование фитопланктона Белого моря проводилось в 2003 г. (Ильяш и др., 2003), при этом авторы не приводят в своей работе количественных характеристик. Также была проведена ревизия таксономического разнообразия динофитовых водорослей (Okolodkov, 1998). Краткий анализ доминантов и динамики количественных характеристик фитопланктона приводится в статье 2018 г. (Ilyash et al., 2018), менее подробно эти характеристики представлены в более ранних работах (Гогорев, 2005; Ильяш и др., 2011; Македонская, Мохова, 2017). Межгодовая и сезонная динамика фитопланктона Белого моря также были предметом изучения (результаты, полученные в XX веке, обобщены в работе Ильяш с соавт., 2003). Данные о сезонных изменениях фитопланктона в 1989 г. приведены в работе Гогорева (Гогорев, 2005). Последнее исследование сезонной динамики фитопланктона на разных глубинах проведено в 2017 г. (Радченко и др., 2022). Все авторы подтверждают сезонный характер развития фитопланктона в Белом море, что, главным образом, связано с изменениями абиотических условий. Чаще всего выделяют два пика биомассы – весенний и летний, реже фиксируется менее выраженный осенний пик биомассы (Ильяш и др., 2003; Гогорев, 2005; Македонская, Мохова, 2017; Ilyash et al., 2018; Македонская и др., 2021; Радченко и др., 2022). На берегах Белого моря расположено несколько биологических стационаров, на которых регулярно проводятся исследования фитопланктона. Накоплен большой объем данных, что является хорошей основой для анализа происходящих межгодовых и внутрисезонных изменений. Продолжение исследований фитопланктона дополняет и уточняет имеющиеся данные, позволяя наиболее адекватно оценивать его современное состояние. Целью данной работы было изучение качественного состава и количественных характеристик фитопланктона Кандалакшского залива Белого моря в весенне-осенний период 2021 г.
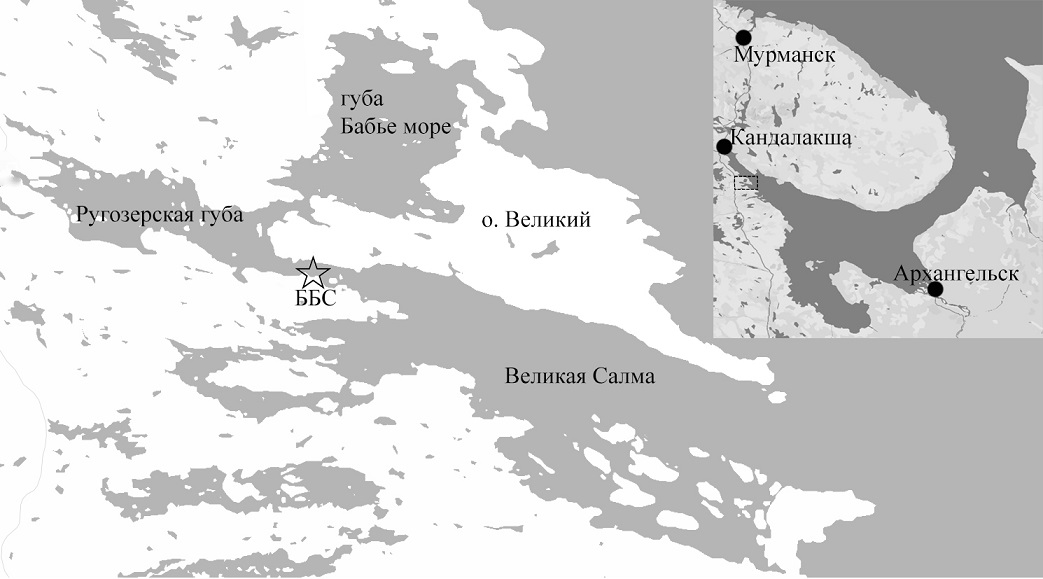
Материалы и методы Материалом для работы были пробы, собранные в Кандалакшском заливе Белого моря, в проливе Великая Салма, рядом с причалом ББС МГУ (66°33'13.8"N 33°06'17.3"E) (рис. 1). Кандалакшский залив отличается сильной изрезанностью береговой линии. Большая часть прилегающей к ББС акватории мелководна, и сильные приливно-отливные течения обеспечивают полное перемешивание воды и однородность её характеристик по всей толще (Каталог..., 2008). Выбор точки отбора проб обусловлен в первую очередь её доступностью и простотой отбора образцов с неё, что делает её потенциально пригодной для мониторинговых работ в дальнейшем.
Рис. 1. Местоположение точки отбора проб Fig. 1. Location of the sampling point
Отбор проб проводили в самом конце фазы прилива или на полной воде с 20 мая по 25 сентября 2021 г. Всего отобрано по 13 качественных и количественных проб. Количественные пробы объемом 1 л отбирали в поверхностном горизонте (0–0,5 м) в пластиковые бутыли. Качественные пробы отбирали одновременно с количественными, с использованием планктонной сети из мельничного газа №76. Пробы фиксировали формалином (концентрация в пробе 2–3%). Камеральная обработка проб фитопланктона проводилась в соответствии с методиками, принятыми в морской гидробиологии (Современные методы…, 1983; Федоров, Капков, 2006; Радченко и др., 2010). Количественные пробы концентрировали до объема 40–50 мл при помощи камеры обратной фильтрации с лавсановым фильтром с диаметром пор 2 мкм, и дополнительно сгущали до объема 1–3 мл методом седиментации. В дальнейшем эти пробы анализировали для определения видового состава, численности и биомассы фитопланктона. Для подсчета численности использовали счётную камеру Фукса-Розенталя (глубина 200 мкм, объём счётного поля камеры 0,0032 мл), клетки подсчитывались в 8–16 счётных полях (в зависимости от их концентрации). Расчет биомасс микроводорослей производили по клеточному объему, который вычисляли методом геометрического подобия с использованием рекомендованных систем аппроксимации к простым геометрическим телам, используя линейные размеры клеток (Hillebrand et al., 1999; Радченко и др., 2010). Качественные пробы, отобранные с помощью планктонной сети, использовали как дополнительный материал для уточнения видового состава и определения ряда видов. Названия видов даны с учётом современных номенклатурных ревизий согласно базе данных AlgaeBase (Guiry, Guiry, 2022). Для определения водорослей использовали определители и дополнительную литературу (Диатомовый анализ, 1949, 1950; Киселев, 1950; Диатомовые водоросли…, 1992, 2002, 2006; Коновалова, Селина, 2010; Identifying…, 1997; Hoppenrath et al., 2009; Gogorev, Samsonov, 2016) и интернет-ресурс «Nordic Microalgae» (Karlson et al., 2020). Определение и подсчёт водорослей проводились при помощи светового микроскопа Leica DM500 с использованием увеличения 40x×10x. Для определения ряда видов диатомовых водорослей изготавливали постоянные препараты, материал выжигали кипячением в концентрированной перекиси водорода с последующим заключением в анилин-формальдегидную смолу, препараты изучались с использованием иммерсионного объектива, увеличение100х10. Мы не учитывали представителей пикопланктона, а также виды с размером клеток менее 10 мкм, за исключением некоторых представителей диатомовых водорослей, систематическую принадлежность которых можно уверенно установить и при меньших размерах клеток. Вклад видов в численность и биомассу определялся как отношение численности/биомассы вида к суммарной численности/биомассе пробы. К доминантам относили виды, вклад которых в суммарную численность или биомассу составляет не менее 10%. Для количественной оценки разнообразия сообщества мы использовали индекс Шеннона. Этот индекс вычисляли по формуле
где p – представленность вида в сообществе. Для оценки сходства сообществ фитопланктона использовали индекс Сёренсена:
где c – количество видов, общих для обеих проб, a и b – количество видов, встреченных только в одном из каждых сравниваемых сообществ; для количественных показателей:
где Ai и Bi – количественные показатели, отмеченные в каждом из сообществ (Magurran, 1988).
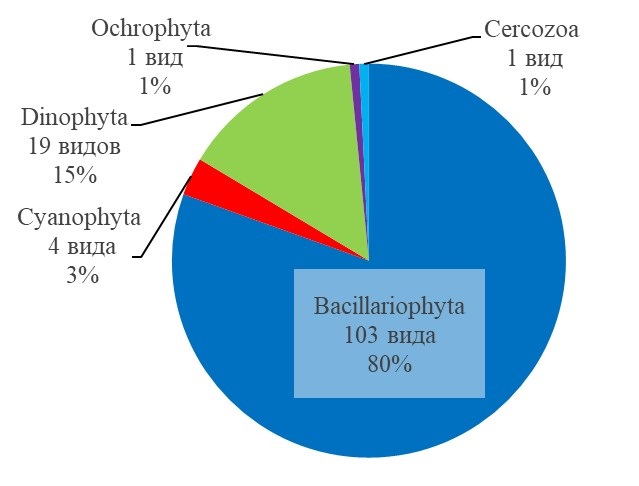
Результаты Таксономический состав фитопланктона Всего в исследованных пробах фитопланктона было выявлено 128 таксонов микроводорослей, относящихся к 5 отделам (рис. 2, табл. 1). Наиболее представлены Bacillariophyta, составляющие 80% разнообразия, доля Dinophyta составила 15%, Cyanophyta – 3%, Ochrophyta и Cercozoa – по 1%.
Рис. 2. Таксономическая структура фитопланктона Fig. 2. Phytoplankton taxonomic structure
Среди водорослей из отдела Bacillariophyta выявлен 41 род (103 таксона, из которых 27 идентифицированы только до уровня рода), из которых наиболее представлены роды Chaetoceros (21 вид), Synedra (8 видов), Coscinodiscus (7 видов), Navicula (6 видов), Nitzschia (6 видов). Отдел Dinophyta представлен 10 родами (19 таксонов, из которых 3 определены до уровня рода) – 6 видов Protoperidinium, 3 вида Dinophysis, 3 вида Tripos, в остальных родах отмечено по одному виду. Отдел Ochrophyta представлен единственным видом Octactis speculum (Ehrenberg) F.H.Chang, J.M.Grieve & J.E.Sutherland, отдел Cercozoa – видом Ebria tripartita (Schumann) Lemmermann. Отдел Cyanophyta представлен видами Nodularia spumigena Mertens ex Bornet & Flahault, Merismopedia sp. и двумя неидентифицированными родами. Количество видов в пробах варьировало от 30 до 59 (рис. 3). Минимальное количество таксонов в пробе было отмечено 20 мая и 25 сентября (30 и 37 видов соответственно), а максимальное – 30 июня и 13 августа (57 и 59 видов соответственно). Во всех пробах большая часть видов представлена диатомовыми водорослями, на втором месте — динофитовые водоросли.
Рис. 3. Количество таксонов фитопланктона, отмеченное в разные периоды наблюдений Fig. 3. Phytoplankton taxa number in different periods at the station studied
Диатомовые Cylindrotheca closterium (Ehrenberg) Reimann & J.C.Lewin, Licmophora sp. и Thalassionema nitzschioides (Grunow) Mereschkowsky были отмечены на протяжении всего исследования, во всех пробах. В большей части проб встречались представители родов Chaetoceros, Coscinodiscus, Melosira, а также Ditylum brightwellii (T.West) Grunow и ряд других видов. Динофитовые Dinophysis acuminata Claparède & Lachmann, D. norvegica Claparède & Lachmann, Protoperidinium pallidum (Ostenfeld) Balech, Scrippsiella acuminata (Ehrenberg) Kretschmann, Elbrächter, Zinssmeister, S.Soehner, Kirsch, Kusber & Gottschling, Tripos longipes (Bailey) F.Gómez и T. fusus (Ehrenberg) F.Gómez также были отмечены более чем в половине проб. Представители других отделов встречались в пробах реже (табл. 1, табл. 2).
Таблица 1. Список таксонов фитопланктона и их количественные характеристики ТАБЛИЦА ОТКРЫВАЕТСЯ ПРИ НАЖАТИИ НА ССЫЛКУ Table 1. Phytoplankton species and their numerical features THE TABLE CAN BE SEEN BY CLICKING ON THE LINK
Количественные показатели фитопланктона Общая численность фитопланктона варьировала от 1,84 млн кл./м3 (в августе) до 23,27 млн кл./м3 (в июле) (рис. 4). В начале лета численность фитопланктона увеличивается (кроме 14 июля, когда она уменьшилась, но после этого снова росла). Максимальные значения численности зафиксированы 22 июля, при этом в состав доминантов по численности входили Chaetoceros cinctus Gran, Chaetoceros sp., Thalassionema nitzschioides (табл. 2). После 22 июля наблюдалось резкое падение численности, в августе численность оставалась низкой, а в сентябре регистрировался небольшой рост.
Рис. 4. Сезонная динамика численности различных групп в общей численности фитопланктона Fig. 4. Seasonal variation of different phytoplankton groups to total phytoplankton abundance
Общая биомасса фитопланктона колеблется от 31,4 мг/м3 (20 мая) до 246,7 мг/м3 (28 июля) (рис. 5). Пики биомассы можно выделить 30 июня (220,26 мг/м3) и 28 июля (246,7 мг/м3), а также (менее выраженный) 20 августа (145 мг/м3). Все три пика биомассы связанны с развитием крупноклеточных диатомовых водорослей Coscinodiscus concinnus и C. asteromphalus. 30 июня, кроме того, в состав доминантов по биомассе входит динофитовая водоросль Scrippsiella acuminata, а 20 августа диатомея – Melosira moniliformis (Link) C.Agardh (табл. 2).
Рис. 5. Сезонная динамика биомассы различных групп в общей биомассе фитопланктона Fig. 5. Seasonal variation of different phytoplankton groups to total phytoplankton biomass
Максимальные значения общей численности и общей биомассы фитопланктона в исследованный период приходятся на разные даты, в первую очередь, за счет развития крупноклеточных видов р. Coscinodiscus, которые вносят большой вклад в биомассу при небольшом вкладе в численность. В исследованный период наибольшая доля фитопланктона (как по значениям численности, так и по значениям биомассы) приходится на диатомовые водоросли, кроме того, значительна роль динофитовых. Вклад динофитовых водорослей увеличивается несколько раз – 30 июня (в первую очередь в численность), 8 и 22 июня (в биомассу), 13 августа (и в численность, и в биомассу), с конца августа доля динофитовых и по численности, и по биомассе уменьшается.
Таблица 2. Структурные характеристики фитопланктона ТАБЛИЦА ОТКРЫВАЕТСЯ ПРИ НАЖАТИИ НА ССЫЛКУ Table 2. Structural features of phytoplankton THE TABLE CAN BE SEEN BY CLICKING ON THE LINK
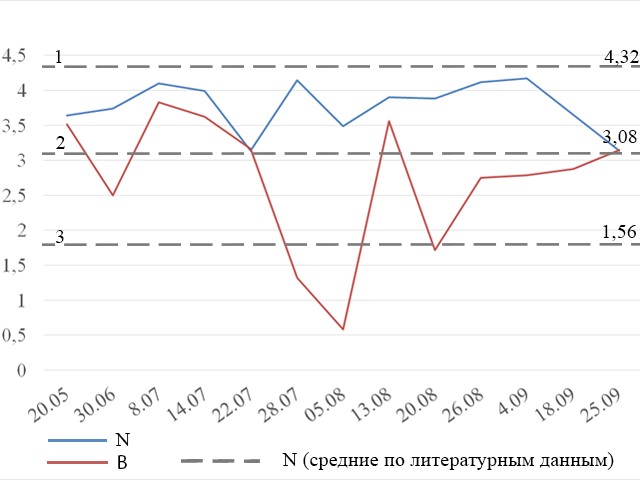
Оценка разнообразия и сходства сообществ фитопланктона Индекс Шеннона, рассчитанный по данным численности микроводорослей, изменяется в течение сезона от 3,1 (22 июля и 25 сентября) до 4,2 (4 сентября). Сравнительно низкие значения индекса приходятся на 22 июля (3,1), 5 августа (3,5) и 25 сентября (3,1) (рис. 6). Индекс Шеннона, рассчитанный по данным биомассы водорослей, варьирует гораздо сильнее: от 0,6 (5 августа) до 3,8 (8 июля), наиболее низкие значения приходятся на 30 июня (2,5), 5 августа (0,6) и 20 августа (1,7). На рис. 6 показаны значения индекса Шеннона в пробах в сравнении с литературными данными.
Рис. 6. Значения индекса Шеннона, рассчитанного для данных по численности (N) и биомассе (B) фитопланктона. Fig. 6. Shannon index values for phytoplankton abundance (N) and biomass (B) data.
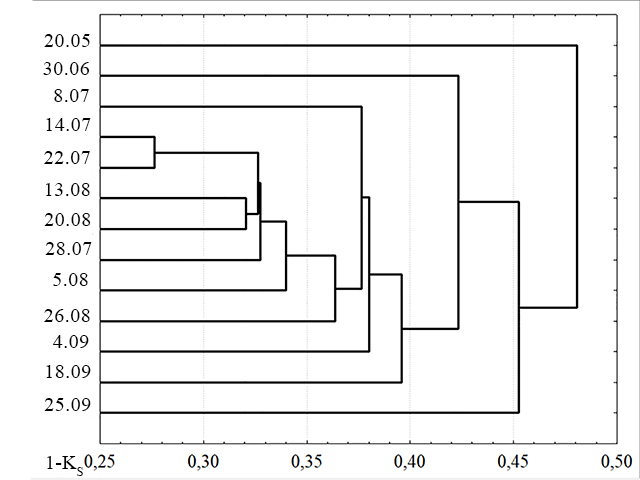
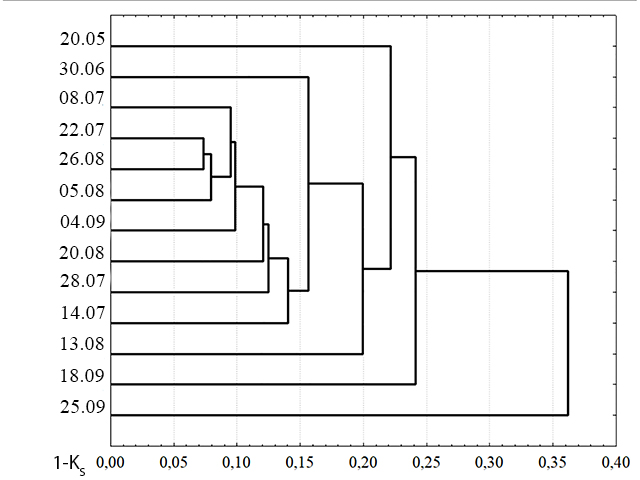
При попарном сравнении значений индекса Сёренсена для видовых списков всех проб выявлено, что заметно отличаются от остальных проб пробы 20 мая и 25 сентября. Кроме того, проба 30 июня ближе ко всем остальным, чем первые две, но также достаточно сильно отличается от них (рис. 7).
Рис. 7. Сходство сообществ фитопланктона в пробах по данным видовых списков. Fig. 7. Dendrogram constructed from Sørensen similarity matching index by check-list species using nearest neighbors algorithm
Сравнения значений индекса Сёренсена для данных численностей видов дает похожие результаты (рис. 8).
Рис. 8. Сходство сообществ фитопланктона в пробах по данным численностей видов. Fig. 8. Dendrogram constructed from Sørensen similarity matching index by species abundance using nearest neighbors algorithm
В пробе 20 мая показатели общей численности и биомассы низки, и при этом доминируют бентосные виды Cocconeis sp. (по численности и биомассе), Navicula sp. (только по численности), Licmophora sp. (только по биомассе) (табл. 2). Эти виды, не являясь собственно планктонными, могли в таких количествах оказаться в планктоне из сообществ перифитона, поскольку место отбора проб близко к берегу, а пролив Великая Салма достаточно узкий и неглубокий. В пробе 30 июня среди доминантов по численности сохраняется высокая доля перифитонного вида Cocconeis sp., кроме этого по численности доминирует S. acuminata, а по биомассе – C. concinnus, последние два вида уже собственно планктонные. Анализируя дендрограммы, построенные по данным видового состава и численности (рис. 6 и рис. 7), мы можем выделить группу схожих проб, с 30 июня по 18 сентября. Если судить по составу доминантов, с 14 июля по 18 сентября наблюдается преобладание летнего комплекса видов. В этот период в большей части проб по численности преобладает T. nitzschioides, по биомассе C. сoncinnus, а также во многих пробах высока доля рода Chaetoceros. Кроме того, среди доминантов за этот период отмечены M. moniliformis, S. costatum и другие (табл. 2). На дендрограммах по данным видовых списков период преобладания летнего комплекса видов выявляется с 8 июля по 4 сентября, при анализе численности этот период продлевается до 18 сентября. В сентябре заметно возрастает численность S. costatum, но так как этот вид имеет небольшие размеры клеток, то его вклад в биомассу невелик.
Обсуждение В летний период 2021 г. в Кандалакшком заливе Белого моря (у ББС МГУ) нами было выявлено 128 таксонов. Наиболее представлены диатомовые водоросли, следующая по числу видов группа – динофитовые, среди других отделов отмечены только несколько видов. Похожие данные приводят и другие исследователи (Гогорев, 2005; Замётная, Македонская, 2018; Ilyash et al., 2018; Радченко и др., 2022). Так, в исследовании сезонной динамики губы Чупа Кандалакшкского залива в 2017 г. было отмечено 185 таксонов, из которых 94 приходилось на диатомовых, 51 – на динофитовых (Радченко и др., 2022). В нашем исследовании пик численности фитопланктона приходился на 22 июля (23,27 млн кл./м3), кроме того, увеличивалась численность фитопланктона в конце сентября (до 13,8 млн кл./м3). В 2017 г. пик численности приходился на 2 сентября (Радченко и др., 2022), а в исследовании Гогорева в 1989 г. пик численности приходился на 18 июля, примерно как и в нашем исследовании, но значение общей численности фитопланктона было более высокое – до 1200 млн кл./м3 (Гогорев, 2005). При этом значения численности, приведённые в работе Гогорева (2005) для июньских проб, меньше наших – 1,8–3,9 млн кл./м3, т.е. амплитуда колебаний численности в 2021 г. была ниже, чем в 1989. Среди отмеченных нами доминантов (табл. 2), практически все виды относятся к диатомовым водорослям. При этом достаточно много видов, характерных для перифитона (особенно в пробах, относящихся к началу летнего сезона) – виды родов Cocconeis, Licmophora, Navicula, Synedra. Это, вероятно, связанно с общей изрезанностью береговой линии Кандалакшского залива, а также с тем, что наши пробы были отобраны недалеко от берега, где в составе планктонного сообщества оказываются перифитонные виды. Единственным видом динофитовых водорослей, который мы отметили в качестве доминанта, была S. acuminata, хотя другими исследователями отмечались как доминанты Tripos arcticus (Ehrenberg) F.Gómez 2021, T. longipes и T. fusus, Gymnodinium wulffii J.Schiller, Prorocentrum balticum (Lohmann) Loeblich III (Ильяш и др, 2003), Dinophysis norvegica (Ильяш и др, 2003; Гогорев, 2005), D. acuminata (Радченко и др., 2018). В качестве нетипичных доминантов отмечали Heterocapsa triquetra (Ehrenberg) F.Stein и виды р. Protoperidinium (Ильяш и др., 2016). Однако нами эти виды в качестве доминантов отмечены не были (а некоторые не были отмечены и вовсе), хотя в период развития осеннего фитопланктона можно было бы ожидать развития динофитовых водорослей. Отличия полученных нами данных от данных других исследователей отчасти могут быть связаны с локальными отличиями гидрофизических условий. Так, в работе Житиной с соавторами было показано, что интенсивность приливного перемешивания (приводящего, в результате, к обогащению поверхностного слоя питательными веществами, включая кремний) влияет на то, будет ли сообщество с доминированием диатомей сменяться сообществами с доминированием динофитовых водорослей (Zhitina, 2016). В период исследования в 2021 г. 22 июля нами зарегистрировано максимальное значение общей численности фитопланктона (23,3 млн кл/м3), но минимальное значение индекса Шеннона (3,1), рассчитанного по данным численности микроводорослей. Похожие данные приводят Замётная и Македонская (2018) для Кандалакшского залива, где в 2015 г. в июне была отмечена гораздо более высокая общая численность фитопланктона, чем в нашем исследовании – численность колебалась от 9,22 до 1070,41 млн кл./м3 и в среднем составила 438,32 млн кл./м3, а индекс Шеннона при этом был довольно низким – от 0,62 до 3,8 (среднее значение – 1,67). При этом минимальное значение индекса Шеннона соответствовало максимальному значению общей численности и наоборот (Замётная, Македонская, 2018). Наши значения индекса Шеннона, рассчитанного по численности, для июньских проб выше тех значений, которые приводятся у Замётной и Македонской, а общая численность фитопланктона значительно ниже. Индекс Шеннона (рассчитанный по численности) в исследовании, посвящённом фитопланктону Онежского залива, изменялся от 1,56 до 4,32 в разные годы (Македонская и др., 2021), и при сравнении с этими данными можно предположить, что описанное нами сообщество обладает средней для Белого моря степенью разнообразия. В исследовании Двинского залива в осенний период в разные годы общая численность фитопланктона варьировала от 3,58 до 34,02 млн кл./м3 (Македонская, Мохова, 2017); значения численности для наших проб, отобранных в сентябре, хорошо соотносятся с этими данными и изменяются от 2,5 до 13,2 млн кл./м3. В нашем исследовании высокие значения общей биомассы фитопланктона отмечены 30 июня и 28 июля, и менее выраженный пик – 20 августа. В 2017 г. в губе Чупа пики биомассы отмечались 10 мая и 2 сентября (Радченко и др., 2022), при этом характерного, согласно более ранним данным (Ильяш и др., 2003), для Белого моря летнего пика биомассы авторы не отметили. На даты, в которые отмечены пики биомассы, приходятся и уменьшения значений индекса Шеннона, рассчитанного по биомассе – 30 июня он составил 2,5, 28 июля – 1,3 и 20 августа – 1,7. При этом минимального значения индекс Шеннона достигает в следующей после 28 июня пробе – 5 августа, хотя биомасса в этой пробе сильно падает в сравнении с пиком 28 июня. В исследовании Двинского залива в осенний период в разные годы общая биомасса фитопланктона составляла от 175,33 до 429,25 мг/м3 (Македонская, Мохова, 2017), в нашем же исследовании общая биомасса для сентябрьских проб значительно ниже и колеблется от 37,3 до 79,2 мг/м3.
Заключение В исследованный период 2021 г. структурные и количественные показатели фитопланктона, отмеченные нами для района ББС, в целом, соответствуют показателям, полученными другими исследователями в разные годы для фитопланктона Белого моря. Однако следует отметить некоторые особенности. Количественные показатели для представителей отдела Dinophyta были заметно ниже, чем обычно в этот период года. Так, T. fusus и D. norvegica – виды, обычные для летних месяцев, часто отмечаемые как доминанты (например, по данным Гогорева (2005) в 1989 г. доля от общей численности фитопланктона для этих видов в августе доходила до 25% и 50% соответственно) – в нашем исследовании не входили в состав доминантов. Также упоминается как доминант и D. acuminata (Радченко и др., 2018). Однако из представителей этого отдела только один вид – S. acuminata – был среди доминантов в нашем исследовании.
Работа выполнена в рамках научного проекта государственного задания МГУ № 121032300080-0. Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данном сообщении. Благодарности. Авторы выражают благодарность за сбор проб сотрудникам биологического факультета МГУ Бубновой Екатерине Николаевне, Ворцепневой Елене Владимировне, Грум-Гржимайло Ольге Алексеевне, Неретину Николаю Юрьевичу и Прудковскому Андрею Андреевичу.
Список литературы
Статья поступила в редакцию 16.12.2022
Об авторах Резник Евгения Владиславовна – Evgenia V. Reznik студент, Московский государственный университет им. М.В.Ломоносова, Москва, Россия (Lomonosov Moscow State University, Moscow, Russia), биологический факультет, кафедра микологии и альгологии Jenny-Reznik@yandex.ru Георгиев Антон Александрович – Anton A. Georgiev кандидат биологических наук semga2001@yandex.ru Корреспондентский адрес: Россия, 119234, г. Москва, Ленинские горы, д. 1, стр. 12, Биологический факультет МГУ. Телефон (495)-939-27-64.
ССЫЛКА: Резник Е.В., Георгиев А.А. Видовое разнообразие и структура фитопланктона в проливе Великая Салма (Кандалакшский залив, Белое море) в 2021 году // Вопросы современной альгологии. 2023. №1 (31). С. 42–59. URL: http://algology.ru/2018 DOI – https://doi.org/10.33624/2311-0147-2023-1(31)-42-59 EDN – WFFQWC
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
Species diversity and community structure of phytoplankton in the Velikaya Salma Strait (Kandalaksha Bay, White Sea) in 2021 Evgenia V. Reznik, Anton A. Georgiev Lomonosov Moscow State University (Moscow, Russia)
Key words: phytoplankton; WSBS MSU; White Sea; Russia; taxonomical diversity; biomass; abundance
References
Authors Reznik Evgenia V. ORCID – https://orcid.org/0000-0002-9755-5429 Lomonosov Moscow State University, Moscow, Russia Jenny-Reznik@yandex.ru Georgiev Anton A. ORCID – https://orcid.org/0000-0002-9185-2721 Lomonosov Moscow State University, Moscow, Russia semga2001@yandex.ru
ARTICLE LINK: Reznik E.V., Georgiev A.A. Species diversity and community structure of phytoplankton in the Velikaya Salma Strait (Kandalaksha Bay, White Sea) in 2021. Voprosy sovremennoi algologii (Issues of modern algology). 2023. № 1 (31). P. 42–59. URL: http://algology.ru/2018 DOI – https://doi.org/10.33624/2311-0147-2023-1(31)-42-59 EDN – WFFQWC When reprinting a link to the site is required Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor, please and we send it to you with pleasure for free.
На ГЛАВНУЮ
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ
|
|||
|
| ||