|
|
|
Микроводоросли как биотехнологические объекты
Олескин А.В.1, Цао Боян2 Alexander V. Oleskin, Cao Boyang
УДК 579.61+579.66+579.67+581.1
Микроводоросли в широком смысле (зеленые, красные, бурые, диатомовые, а также цианобактерии) более полувека находятся в центре внимания ученых и технологов как ценные и экономичные продуценты пищевых добавок, кормов для животных, косметических средств, лекарственных препаратов, биологических удобрений, биотоплива, а также при очистке сточных вод (биоремедиации). В последние годы микроводоросли находят все большее применение в роли источников биологически активных соединений, включая гормоны, нейромедиаторы и иммуностимуляторы. Настоящая работа подытоживает актуальные данные, полученные в лабораториях всего мира, и рассматривает, каким образом микроводоросли и их продукты удовлетворяют требованиям, предъявляемым в настоящее время к объектам биотехнологии, опирающейся ныне на синтетическую биологию, феномику и интернет вещей (IoT). Ключевые слова: микроводоросли; водные экосистемы; биотехнология; биотопливо; функциональное питание; биологические удобрения; очистка сточных вод; биоремедиация; косметика; фармакология; синтетическая биология; феномика; интернет вещей
Список сокращений: БАД – биологически активная добавка;
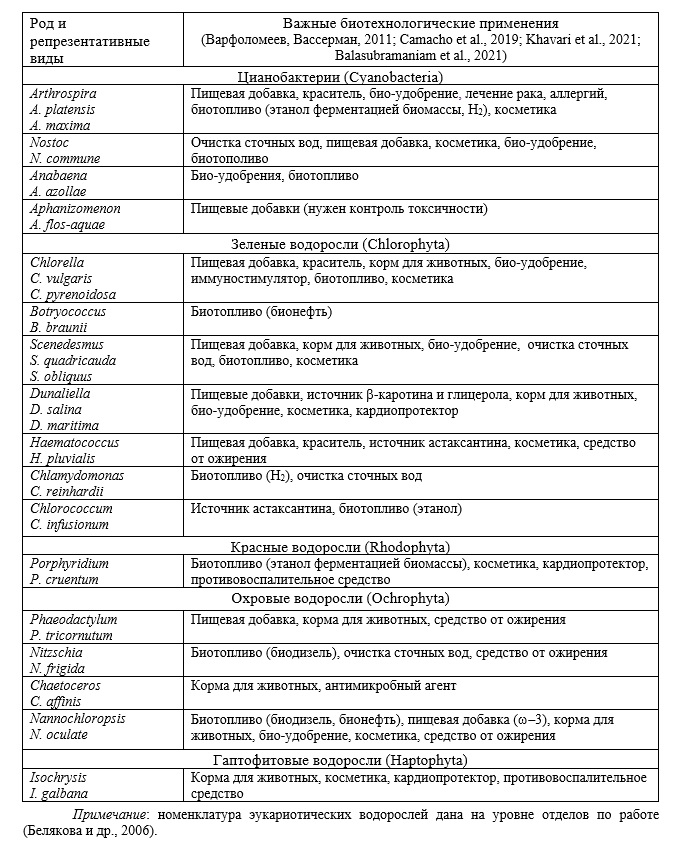
Настоящая работа посвящена современным применениям эукариотических микроводорослей, а также некоторых прокариот (цианобактерий) в биотехнологических целях. Данная тематика была в центре интереса международного научного сообщества на протяжении последних десятилетий (Kay et al., 1991; Norton et al., 1996; Spoalore et al., 2006; Варфоломеев, Вассерман, 2011; Феофилова, Мысякина, 2016; Camacho et al., 2019; Fabris et al., 2020; Balasubramaniam et al., 2021; Khavari et al., 2021; Sompura et al., 2021). Микроводоросли условно определяются как микроскопические одноклеточные, колониальные или нитевидные организмы размером от ~ 1 до ~ 900 микрон. Предполагается существование примерно 800 000 видов микроводорослей, из которых описано не менее 50 000 видов (Ronga et al., 2019). Микроводоросли ныне важны как источники фармацевтических препаратов, пищевых добавок и препаратов, косметических средств, биотоплива, био-удобрений, кормов для различных животных, агентов для очистки сточных вод (Camacho et al., 2019; Fabris et al., 2020; Balasubramaniam et al., 2021; Khavari et al., 2021). Все указанные области применения микроводорослей находятся в орбите современной биотехнологии как «любого технологического приложения, которое использует биологические системы, живые организмы или их производные для создания или модификации продуктов или процессов» (UN Convention on Biological Diversity, 2022). Цианобактерии (филум Cyanobacteria) включают многочисленные биотехнологически ценные представители (Таблица). Далеко не исчерпывающий перечень ныне широко применяемых продуцентов ценных соединений включает представителей родов Arthrospira (отдел Oscillatoriales; особенно отметим вид A. platensis[1], применявшийся в пищу ацтеками в Центральной Америке и племенами в районе озера Чад в Африке), Nostoc (отдел Nostocales; вид N. commune ныне применяется для био-очистки, или ремедиации, техногенно загрязненных почв – Дидович и др., 2017), Anabaena и Aphanizomenon (тот же отдел). [1] Прежнее название было Spirulina platensis, поэтому и производившаяся с начала 1970-х годов на ее основе во Франции биодобавка носила название Spirulina.
Что касается эукариотических микроводорослей, то здесь также предложим репрезентативный (неполный) список биотехнологически важных родов. К отделу зеленые водоросли (Chlorophyta) в составе империи Plantae принадлежат широко используемые в лабораториях модельные объекты и «рабочие лошадки» современной биотехнологии – представители родов Chlorella, Dunaliella, Scenedesmus, Haematococcus, Chlamydomonas, Botyococcus, Chlorococcum, которые имеют потенциальные или уже актуальные применения как лекарственные, диетические, косметические средства. В биотехнологии, в том числе медицинской, применимы и микроскопические красные водоросли (отдел Rhodophyta), например, виды рода Porphyridium; красные водоросли также входят в состав империи Plantae (Белякова и др., 2006). К ней не относятся микроводоросли, включенные в альтернативную империю Chromalveolata (Белякова и др., 2006), замененную в ряде последних работ на кладу (супергруппу) SAR, или Harosa (Cavalier-Smith, 2018; Strassert et al., 2019), к которой принадлежит царство Stramenopila[2], включающее такие биотехнологически важные рода, как, например, Phaeodactylum, Chaetoceros, Nannochloropsis, Nitzschia (все представляют отдел Ochrophyta). К той же таксономической группе относится царство Haptophyta с применяемыми в косметике представителями р. Isochrysis (отдел Prymnesiophyta) (Белякова и др., 2006). [2] В цитированном в тексте учебнике (Белякова и др., 2006) дается латинское написание царства – Straminopila, однако в первоисточниках написано Stramenopila (Patterson, 1989), при том что русский вариант все равно должен быть «страминопилы», в соответствии с английской фонетикой.
Микроводоросли в используемом здесь широком значении (с включением цианобактерий) обладают несомненными практическими преимуществами по сравнению с другими источниками биотехнологических продуктов. Во-первых, микроводоросли не требуют больших посевных площадей, например в рамках задачи производства биотоплива, в отличие от его более традиционных источников (кукуруза, сахарный тростник, масличные пальмы и др.). Во-вторых, большинство микроводорослей отличается высокой скоростью роста и простотой условий культивирования (требуя лишь минеральные соли, СО2 и освещение), что особенно важно, например, при производстве в больших масштабах вакцин или моноклональных антител с помощью генномодифицированных микроводорослей (Khavari et al., 2021). В то же время, биотехнологическое применение водорослей наталкивается на ряд типичных трудностей. Для многих продуктов, получаемых на базе микроводорослей, недостаточен размер глобального рынка, слишком высока себестоимость, что требует усовершенствования соответствующих биотехнологий, недостаточно гарантирована пищевая или лекарственная безопасность и имеются проблемы с соответствием национальным и международным юридическим нормам, а также наблюдается неготовность клиентов пользоваться нетрадиционными пищевыми ингредиентами (скажем, биомассой хлореллы или ее экстрактом) или лекарственными препаратами (Camacho et al., 2019; Balasubramaniam et al., 2021). Серьезной методической проблемой является масштабирование производства на базе микроводорослей – переход от лабораторных установок к пилотным и далее промышленным.
Важнейшим этапом любого биотехнологического проекта на базе микроводорослей является их культивирование. Микроводоросли выращивают или в фотобиореакторах (ФБР), или в открытых водоемах – естественных (прудах, озерах, бухтах) или искусственных (циркулярного или лоткового типов). Используется солнечный или искусственный свет; процесс может быть периодическим или, что предпочтительно в современной биотехнологии, непрерывным (режим протока). Среда может быть минеральной (фототрофное, зависимое от света культивирование) или же содержать органические компоненты, т.е. обеспечивать смешанный фото-гетеротрофный режим, стимулирующий рост многих микроводорослей (Balasubramaniam et al., 2021). ФБР представляют контролируемую закрытую систему культивации, снижающую вероятность проникновения чужеродных микроорганизмов. Они подразделяются на трубчатые (система прозрачных пластиковых или стеклянных трубок, позволяющая максимизировать интенсивность освещения); вертикальные колонного типа (стеклянная колонка с донной форсункой, подающей СО2/воздух); плоские (в том числе тонкостенные полиэтиленовые мешки) (Dragone et al., 2010). Выход биомассы в ФБР значительно выше, нежели в открытых водоемах. В то же время выращивание микроводорослей в открытых водоемах – более экономичный метод крупномасштабного биотехнологического производства. Он представляет пример экосистемной биотехнологии, когда успех производства во многом зависит от управления сложными взаимоотношениями между всеми компонентами создаваемой экосистемы. Если осуществляется смешанное культивирование нескольких видов водорослей (например, хлореллы и сценедесмуса), то между их популяциями могут устанавливаться конкурентные отношения с вытеснением одного из видов или же развитие экосистемы ведет к их устойчивому сосуществованию. Так, имеется антагонизм цианобактерий (Anacystis) и зеленых водорослей (Chlorella, Scenedesmus, Chlamydomonas, Haematococcus) (Остроумов, 1986) и в то же время возможен и симбиоз – развитие продуцента углеводородов Botryococcus braunii стимулируется бактериями-спутниками (Сассон, 1987). Культивирование водорослей в биотехнологических целях завершается отделением их биомассы, что достигается ее агрегированием (обработка ультразвуком или флоккулирующими агентами), флотацией (сбор биомассы в форме поверхностной пленки), центрифугированием или фильтрацией, которая в случае малых клеток водорослей (размером порядка микрона) требует ультрафильтрационного оборудования. Для удлинения срока годности биомассы, если она не используется немедленно ради отделения ценных продуктов (например, экстракции каротиноидов и иных пигментов, липидов, углеводородов и др.), прибегают к ее высушиванию (дегидратации) распылительной или лиофильной сушкой (Balasubramaniam et al., 2021). Отметим, что современную биотехнологию трудно представить себе без таких инноваций как разработки по синтетической биологии. Это шаг вперед по сравнению с классической генетической инженерией. Речь идет о создании новых геномов с заранее заданными биотехнологическими целями. С точки зрения водной экологии и охраны мирового океана существенное значение имело бы, например, создание микроводоросли с геномом, содержащем гены всех ферментов, необходимых для эффективного расщепления всех компонентов сырой нефти – на случай ее разлития в том или ином водоеме (Fabris et al., 2020). Все эти гены могут быть активированы в нужный момент «по распоряжению» человека путем внедрения в микроводоросль рецепторов для определенных коммуникативных сигналов, например бактериальных аутоиндукторов систем «quorum sensing», ставящих экспрессию оперонов под контроль плотности популяции соответствующих микроорганизмов. Секвенирование геномов микроводорослей способствовало разработке генетических инструментов для зеленой водоросли Chlamydomonas reinhardtii, страминопилов Phaeodactylum tricornutum и Nannochloropsis gaditana, а также цианобактерий Synechocystis sp. PCC 6803 (Fabris et al., 2020). Создавая специализированные базы данных взаимодействий G х E = P, где G – геном, E – окружающая среда и P – получающийся в результате взаимодействия генетических и культуральных факторов фенотип для данного вида водорослей, исследователи могут проводить скрининг естественного и искусственного разнообразия микроводорослей на наличие комбинации аллелей генов, которые будут сочетать основные биотехнологически важные фенотипы, такие как быстрый рост водорослевых культур и высокий удельный выход продукта. Это – так называемая феномика, и она только начинает свое развитие в области биотехнологии микроводорослей. Последние достижения в области феномики высших растений подчеркивают потенциальное влияние методов и технологий феномики на биотехнологию микроводорослей. Например, на основе баз данных феномики был получен мутант резушки Arabidopsis thaliana, который лучше, чем дикий тип, защищен от патогенов и в то же время эффективнее растет за счет фотосинтеза (Fabris et al., 2020). Открывает существенные перспективы и проникновение в биотехнологию Интернета вещей (Internet of Things, IoT), что подразумевает применение сенсоров и обучающихся роботов для создания биотехнологических процессов, автоматически адаптирующихся к любым изменениям условий. У реального биотехнологического процесса на базе постоянно поступающей сенсорной информации создается его цифровой «двойник», то есть виртуальный процесс, позволяющий прогнозировать развитие реального процесса и вносить необходимые технологические изменения с целью повышения выхода биомассы и целевых биотехнологических продуктов и уменьшения количества отходов производства (Олескин, Боян, 2022).
Биотопливо. Данная тематика относится к технологической биоэнергетике (Самуилов, Олескин, 1994) как направлению биотехнологии, связанному с эффективным использованием энергии, запасаемой при фотосинтезе, хемосинтезе и других биологических процессах. Это может быть достигнуто различными путями: 1) превращением биомассы, накопленной в результате фотосинтеза, в дешевое и высококалорийное топливо – биодизель (спиртовые эфиры жирных кислот), метан и другие углеводороды, этанол, бутанол, ацетон, диметилфуран и др.; 2) модификацией самого процесса фотосинтеза, в результате которой энергия света с максимальной эффективностью используется на образование водорода или другого топлива (Олескин и др., 2020; Oleskin, Shenderov, 2020). По сравнению с производством биотоплива на основе специально культивируемых наземных растений (кукуруза, сахарная свекла, рапс) и лигноцеллюлозы на базе древесины, биотехнология с использованием водорослей позволяет получать биотопливо в любое время года, водоросли легко выращиваются, расходуют сравнительно мало воды, не требуют применения пестицидов (Феофилова, Мысякина, 2016; Hamed, 2016). Многие микроводоросли, включая Scenedesmus obliquus, Nannochloropsis sp., Chlorella vulgaris, Nitzschia sp., отличаются высоким содержанием липидов (20–50% и более от сухой массы; Cruz et al., 2018; Balasubramaniam et al., 2021). Эти липиды содержат триацилглицериды. Замещение глицерола на метиловый или этиловый спирт в их молекулах – способ получения биодизеля. Причем, с единицы (1 акра) поверхности для культивирования водорослей можно получить в 30 раз больше биотоплива, чем с использованием наземных растений (Феофилова, Мысякина, 2016). Микроводоросли обладают большим потенциалом в качестве сырья для производства биодизельного топлива (а также для других видов биотоплива), поскольку содержание липидов в их биомассе выше, чем у обычных масличных растений. Биодизель, как и всякое биотопливо, носит возобновляемый характер. Он имеет сравнительно высокую температуру воспламенения, что делает его относительно безопасным биотопливом. К преимуществам биодизеля, по сравнению с минеральным дизельным топливом, относятся также его малая токсичность; он легко разлагается в естественных условиях, дает мало сажи, СО, SO2, несгоревших углеводородов и твердых частиц при сгорании. Применение биодизеля позволяет резко снизить выброс СО2 в атмосферу. Наконец, при сгорании биодизеля как смеси сложных эфиров ощущается приятный фруктовый запах (Феофилова, Мысякина, 2016; Balasubramaniam et al., 2021). Смешивание с дизелем или нефтью биодизеля из водорослей приводит к снижению износа двигателя по сравнению с обычным дизельным топливом и продлевает срок службы этого двигателя (Dasan et al., 2019). Недостатками биодизеля следует признать его высокую вязкость, недостаточную устойчивость к окислению при хранении (Феофилова, Мысякина, 2016). Клетки многих микроводорослей, например Chlamydomonas reinhardtii, содержат большие количества крахмала, откладывающегося в их хлоропластах. Крахмал можно конвертировать в жидкое биотопливо – бутанол, 2,3-бутандиол и особенно этанол (Самуилов, Олескин, 1994; Balasubramaniam et al., 2021). Этанол, экологически чистое топливо, сгорающее до СО2 и Н2О, используется в двигателях внутреннего сгорания в чистом виде или как 10–20%-ная добавка к бензину (газохол). Для производства этанола как топлива биомасса микроводорослей (например Сhlorella vulgaris, Scenedesmus abundans, S. obliquus, S. acuminatus, Porphyridium cruentum, Arthrospira platensis) подвергается предобработке с разрушением клеточных стенок (например, путем замораживания–оттаивания) и кислотным или ферментативным (амилаза, целлюлаза, инвертаза) гидролизом полисахаридов и других биополимеров; далее этанол получается сбраживанием с помощью дрожжей Saccharomyces cerevisiae или бактерий (Zymomonas mobilis, Clostridium thermocellum, Thermoanaerobium brockii и др.) (Balsubramaniam et al., 2021). Биогаз – эффективное газообразное топливо с высокой теплотой сгорания (21–33,5 кДж), состоящее из метана (50–70%), СО2 (30–45%) и небольших примесей других газов (азот, водород, этан, этилен, пропан, сероводород). Биогаз может быть получен на основе конверсии биомассы микроводорослей путем ферментации, которая представляет экосистемную биотехнологию, как и упомянутое выше культивирование водорослей в водоемах. Три стадии процесса – гидролиз биополимеров (полисахаридов, белков и др.) до мономеров; разложение мономеров до органических кислот и спиртов (ацидо- и ацетогенез); собственно образование метана (метаногенез) – часто осуществляются разными микробными видами (например, сам СН4 непосредственно образуется метаногенными археями). Необходимо налаживание их кооперации в создаваемом биотехнологами биореакторе или же проведение разных стадий в разных биореакторах (Самуилов, Олескин, 1994; Balasubramaniam et al., 2021). Продукция биогаза из биомассы водорослей идет более эффективно при содержании липидов не выше 40% в биомассе водорослей (Василенко и др., 2015); эффективность процесса также лимитирована высоким содержанием белка в микроводорослях, что ведет к низкому соотношению углерод : азот (С/N). Для повышения величины С/N до технологически оптимального уровня (10–16) проводят совместную ферментацию биомассы микроводорослей и, например, бумажных отходов (Singh et al., 2014). Механическое препятствие процессу биогазификации, представляемое толстой прочной клеточной стенкой многих водорослей, преодолевается их предварительным нагреванием до 90оС (Suganya et al., 2016). Альтернативу ферментации представляет газификация, или пиролиз, биомассы, при высоких температурах (800–1000оС) с катализаторами[3], причем получается так называемый сингаз, cодержащий, кроме метана, также водород, моноксид углерода и диоксид углерода. Как биогаз, так и сингаз применяются в качестве биотоплива, в том числе для производства электричества (Wang et al., 2017). [3] Возможен пиролиз биомассы и без катализа, при еще более высокой температуре (1300оС).
Как уже было отмечено, большую ценность представляют длинноцепочечные углеводороды (бионефть), содержащиеся в микроводорослях Botryococcus, Isochrysis, Nannochloropsis в значительных количествах (до 75–80% сухой массы). Они легко отделяются от биомассы центрифугированием и могут служить компонентами моторного топлива или сырьем для химической промышленности (Adnan, Hossain, 2018). Во многом принадлежит будущему, но уже активно осваивается производство водорода с помощью водорослей как абсолютно экологически чистого биотоплива с высокой теплотой сгорания (143 кДж/г, что в 2,5 раза превосходит природный газ), которое легко хранить и транспортировать. Процесс вовлекает специфические ферменты (гидрогеназы, нитрогеназу) и сопряжен с фотосинтезом (биофотолиз воды). В качестве подходящих видов широко рассматривают зеленые микроводоросли Chlorella vulgaris, Chlamydomonas reinhardtii и некоторые другие виды, а также цианобактерии Anabaena sp. и Nostoc sp. (Thapa et al., 2016) Нельзя не отметить также непосредственное сжигание биомассы многих микроводорослей ради получения тепла или электроэнергии; недостатком процесса является высокая себестоимость подготовительных стадий (например, сушки биомассы; Aziz, Zainin, 2017).
Пищевые применения микроводорослей. Колоранты. Микроводоросли родов Chlorella, Dunaliella, Haematococcus, а также цианобактерии p. Arthrospira, Aphanizomenon, Nostoc «в целом признаны безопасными» (Generally Regarded As Safe, GRAS), однако при их пищевом, косметическом или фармакологическом применении следует провести тесты на токсичность (Варфоломеев, Вассерман, 2011; Chye et al., 2018). Микроводоросли привлекают внимание пищевых биотехнологов как источники незаменимых аминокислот, углеводов (например, глюкозы и крахмала), витаминов В1, В2, В5, В6, В9, В12, A, C и E, биотина, каротиноидов, фикобилипротеинов (цианобактерии) (Camacho et al., 2019; Scieszka, Klewicka, 2019; Khavari et al., 2021). Микроводоросли являются источниками важных для здоровья организма человека длинноцепочечных ненасыщенных жирных кислот (НЖК), включая кислоты омега-6 (ω-6) типа – линолевую кислоту, γ-линоленовую кислоту, арахидоновую кислоту, а также омега-3 (ω-3) типа, в том числе линоленовую кислоту, эйкозапентаеновую кислоту (ЭПК) и докозагексаеновую кислоту (ДГК). Микроводоросли относятся к легко усваиваемым продуктам, имеют приятный натуральный аромат, могут отличаться низкой калорийностью (Sompura et al., 2021). Все возрастающее пищевое применение находят жидкие культуры (например, хлореллы) и порошки из микроводорослей; ими дополняют и «витаминизируют» пищевые изделия от сыров и кисломолочных продуктов до выпечки и колбасных изделий. Благодаря наличию природных желатинирующих соединений (альгинат, каррагинан и др.), микроводоросли неоценимы как загустители и стабилизаторы пищевых продуктов. Arthrospira platensis (ранее обозначавшаяся как Spirulina platensis) отличается высоким содержанием белка на уровне 50–70% сухого веса (Balasubramaniam et al., 2021). Она обладает питательной ценностью, обусловленной также наличием минеральных компонентов, витаминов, липидов с НЖК, пигментов, углеводов, следовых элементов. A. platensis содержит b-каротин, предшественник витамина А. Она также содержит витамин В12 (120–244 мкг/г сухого веса), хотя его функциональная пригодность для человека нуждается в контроле (Scieszka, Klewicka, 2019). Благодаря своим ценным качествам, биомасса A. platensis и ее компоненты получают приоритетный международный статус в роли лечебного питания, биологически активных добавок (БАД), средств для искусственного вскармливания младенцев, производимых такими лидирующими в мире компаниями как «Saxony-Anhalt» (Германия), «Parry Nutraceuticals» (Индия), «Japan Spirulina Co. Ltd» (Япония). Еще одна крупная компания – «Myanmar Spirulina» (Мьянма) специализируется на таблетках, чипсах, макаронных изделиях, а также жидком экстракте из A. platensis (Balasubramaniam et al., 2021). Подобно Arthrospira, по официальным рекомендациям Организации ООН по продовольствию и сельскому хозяйству и Всемирной организации здравоохранения, зеленые микроводоросли р. Chlorella отличаются высоким содержанием легко перевариваемого белка с хорошо сбалансированным соотношением аминокислот (Swenseid, 1981; Caporgno, Mathys, 2018). К преимуществам хлореллы относятся высокие концентрации в ее биомассе аскорбиновой кислоты, ионов K+, Na+, Mn2+, Ca2+. Chlorella vulgaris соперничает с Arthrospira platensis в роли ценного для веганов источника витамина В12, который присутствует в биомассе хлореллы в подходящей для человеческого организма биологически активной форме метилкобаламина (ГОСТ Р ИСО 16634-1-2011, 2011). Выращивание при низкой интенсивности света способствует накоплению в составе биомассы Chlorella sp. ценных НЖК, а именно a-линоленовой кислоты (Balasubramaniam et al., 2021) В качестве ценного источника белка и других пищевых компонентов особые надежды возлагают на Dunaliella salina, Haematococcus pluvialis, Phaeodactylum tricornutum и некоторые другие виды водорослей (Camacho et al., 2019). Так, в Австралии James Cook University/MBD Energy Research Facility установили наличие достаточного содержания высококачественных белков в биомассе Scenedesmus sp., Nannochloropsis sp., Dunaliella sp. и в пресноводной комбинированной культуре (поликультуре СРС, включавшей Schroederiella apiculate, Scenedesmus pectinatus, Tetraedrom minimum, Mesotaenium sp., Desmodesmus sp.); эта биомасса была вполне сопоставима по качественным характеристикам (включая индекс незаменимых аминокислот, EAAI) с коммерческими продуктами, получаемыми на базе Arthrospira и Chlorella (Kumudha et al., 2015). Тем не менее, использование микроводорослей в качестве источника белка (сырого белка) и других ценных продуктов в пищевой промышленности по-прежнему сопряжено с некоторыми недостатками, главным образом из-за недостаточно развитых технологий и процессов, доступных в настоящее время для переработки микроводорослей (Scieszka, Klewicka, 2019). Помимо этого, использование микроводорослей все еще достаточно слабо развито в мире, поскольку оно требует предварительной разработки новых производственно-сбытовых цепочек с особым вниманием к таким вопросам, как затраты на производство белка водорослей, безопасность пищевых продуктов, возможность экономичного масштабирования производственных процессов и готовность потребителей к нетрадиционным «микроводорослевым» продуктам (Camacho et al., 2019). Микроводоросль Haematococcus pluvialis хорошо известна своим высоким содержанием сильного антиоксиданта и пигмента красного цвета астаксантина, который играет важную роль в пищевой промышленности (как нетоксичный пищевой краситель). Особенно много астаксантина присутствует в покоящихся клетках, которые формируются при неблагоприятных условиях, например, при ярком освещении или высокой солености. Кроме H. pluvialis, астаксантин образуют и другие микроводоросли, например, Chlorella zofingiensis и Chlorococcum sp. Астаксантин из микроводорослей, производимый, в частности, компаниями «Cyanotech Corporation» (США) и «Aquasearch Algatechnologies» (Израиль), дополняет собой мировой рынок астаксантина из морских животных (лосось, креветки, крабы, омары и др.) и получаемого синтетическим путем (компаниями «DSM» в Нидерландах, «BASF» в Швейцарии, «Zhejiang NHU» в Китае). Астаксантин микроводорослей менее токсичен и обладает более сильными антиоксидантными свойствами, чем синтетический аналог (Camacho et al., 2019; Sciezka, Klewicka, 2019; Balasubramaniam et al., 2021; Khavari et al., 2021). К биотехнологически важным пигментам микроводорослей, кроме астаксантина, принадлежат также другие каротиноиды, особенно b-каротин, ликопин, зеаксантин, катаксантин и др. Интенсивно окрашенный оранжевый b-каротин, как уже отмечено, служит предшественником важного для зрения и иммунной системы витамина А и обладает антиоксидантными свойствами, а также выступает как ценный пищевой краситель (колорант) (Варфоломеев, Вассерман, 2011; Balasubramaniam et al., 2021). Зеленая микроводоросль Dunaliella salina содержит до 12–14% b-каротина от сухого веса и, кроме того, до 50% глицерола (при высоких концентрациях NaCl в среде) как сырья для производства нитроглицерина и алкидных смол. b-Каротин из D. salina производится компаниями «Earthrise Nutritionals» (США), «Nature Beta Technologies Cognis» (Австралия). Из-за отсутствия ригидной клеточной стенки, а также высокого содержания белка биомасса водорослей р. Dunaliella легко усваивается и, в частности, используется в хлебопекарной промышленности и в качестве корма для рыб и скота (Camacho et al., 2019; Balasubramaniam et al., 2021). Красно-оранжево-желтая гамма каротиноидов дополняется зелеными оттенками хлорофиллов микроводорослей как важных пищевых красителей. Имеющий сине-зеленый оттенок хлорофилл а, характерный как для зеленых микроводорослей (например, Chlorella), так и для цианобактерий, широко применяется как колорант в силу своей стабильности (Kent et al., 2015). Cинее окрашивание пищевых продуктов достигается получаемыми на базе цианобактерий, например Arthrospira platensis, фикобилипротеинами (особенно промышленно продуцируемыми фикоцианином и аллофикоцианином). Это водорастворимые флуоресцентные пигменты с антиоксидатными свойствами, добавляемые к молочным продуктам, мороженому, жевательной резинке, кондитерским изделиям, безалкогольным напиткам, готовым к употреблению овсяным хлопьям (Dasgupta, 2015).
Корма для животных. Растущий спрос на мясо со стороны населения планеты вызывает необходимость постоянного расширения пахотных земель, отводимых под кормовые культуры, особенно сою. Как альтернативная стратегия, в настоящее время значительная доля продукции биомассы микроводорослей используется в качестве добавки к корму животных, включая крупный рогатый скот, коз, овец, свиней, кроликов, птиц и рыб, а также морских беспозвоночных (Camacho et al., 2019; Balasubramaniam et al., 2021; Remize et al., 2021). Arthrospira spp. предлагается в корм кошкам, собакам, аквариумным рыбкам, декоративным птицам, лошадям, коровам, особенно потому, что она улучшает снабжение их организма незаменимыми жирными кислотами. Crypthecodiniun cohnii и Schizotrichium sp. применяются в птицеводстве, особенно для кур, котoрые в этом случае несут яйца, обогащенные омега-3-ненасыщенными жирными кислотами (Remize et al., 2021). Кратко рассмотренная в начале работы экосистемная технология – выращивание водорослей в составе аквакультур в водоемах – применяется для получения кормовой биомассы таких микроводорослей, как Nannochloropsis, Isochrysis, Pavlova, Phaeodactylum, Chaetoceros, Skeletonema, Thalassiosira, Tetraselmis. Здесь следует особо отметить не только пищевые, но и кормовые добавки на базе Dunaliella salina, что во многом обусловлено высоким содержанием белка (до 57% сухого веса) и углеводородов (до 32% сухого веса) в ее биомассе. «Рабочие лошадки» альгобиотехнологии Chlorella vulgaris и Arthrospira platensis, как уже отмечено, также богаты белками, причем их аминокислотный состав напоминает таковой белков сои – основного белкового корма для животных. Микроводоросли – важный источник незаменимых жирных кислот для рыб, организм которых неспособен синтезировать ненасыщенные жирные кислоты такие, как докозагексаеновая кислота (ДГК) и эйкозапентаеновая кислота (ЭПК). Nannochloropsis sp. и Isochrysis galbana широко используются для обогащения ДГК и ЭПК биомассы зоопланктона, например, коловраток, которые далее скармливаются рыбам или креветкам (Remize et al., 2021). Биомасса С. vulgaris, A. platensis, Micractinium reisseri, Nannochloris bacillaris, Tetracystis sp. содержит ионы железа в значительных концентрациях (Camacho et al., 2019; Balasubramamiam et al., 2021; Remize et al., 2021). Корм, обогащенный даже небольшим количеством биомассы микроводорослей, оказывает позитивное воздействие на физиологию животных, улучшая работу кишечника, а также функционирование иммунной системы, т.е. повышая устойчивость к болезням. Кормовые добавки на базе микроводорослей усиливают сопротивляемость организма животных по отношению к вирусам и бактериям; способствуют увеличению веса животных, например, свиней и птиц. Применение C. vulgaris как кормовой добавки в рацион крупного рогатого скота снижает уровень насыщенных жирных кислот в молоке и повышает долю НЖК, особенно ДГК, в нем (Camacho et al., 2019). Микроводоросли также являются ценным источником питания для личинок моллюсков, ракообразных и рыб (Spoalore et al., 2006; Camacho et al., 2019; Remize et al., 2021). Астаксантин из микроводорослей, в частности, Haematococcus pluvialis, улучшает скорость роста и выживаемость личинок в аквакультуре, а также репродуктивные показатели и качество яиц водных животных благодаря своей антиоксидантной активности. Астаксантин эффективно повышает устойчивость рыб к инфекционным заболеваниям и улучшает их иммунный ответ (Camacho et al., 2019). Астаксантин и другие пигменты микроводорослей используются также для улучшения цвета культивируемых рыб и беспозвоночных. Например, при кормлении содержащими астаксантин микроводорослями р. Haematococcus повышается интенсивность окраски тканей лососевых рыб и моллюсков. При кормлении рыб микроводорослями окраска тканей рыб меняется за счет наличия в биомассе водорослей каротиноидов и, в случае цианобактерий, фикобилипротеинов. Микроводоросль Haslea ostearia применяют для придания голубовато-зеленого оттенка жабрам и губным щупальцам устриц (Варфоломеев, Вассерман, 2011; Adnan, Hossain, 2018).
Биологические удобрения (био-удобрения) на основе микроводорослей. Био-удобрения – это продукты, содержащие живые микроорганизмы или природные вещества, которые способны улучшать химические и биологические свойства почвы, стимулируя рост растений и восстанавливая плодородие почвы. В современном мире био-удобрения вынуждены конкурировать с более широко применяемыми синтетическими удобрениями, причем очевидно, что чрезмерное использование синтетических агрохимикатов привело к массовой экологической деградации во всем мире – к мертвым зонам океана, эвтрофикации, снижению плодородия почв и потере биоразнообразия (Garcia-Gonzalez, Sommerfeld, 2016). Наряду с другими видами био-удобрений и нередко в комбинации с ними (смешанный режим применения био-удобрений), био-удобрения на основе микроводорослей и их компонентов имеют общую целевую задачу повышения плодородия почв и улучшения утилизации растительными культурами макро- и микроэлементов (Guo et al., 2020), включая азот, фосфор, калий, так что биомасса микроводорослей рассматривается как аналог медленно выделяющегося в среду органического удобрения. Например, Arthrospira sp. содержит 6,70% азота, 2,47% фосфора, 1,14% калия по сухому весу (Ronga et al., 2019). Помимо этого, существенное значение имеют содержащиеся в микроводорослях многообразные органические составляющие, например, полисахариды (такие как характерный для хлореллы и некоторых других зеленых микроводорослей b-глюкан), способные стимулировать рост растений (Ronga et al., 2019). В принципе, существует два подхода к применению микроводорослей в качестве био-удобрений. Можно ставить целью повышение активности и усиление роста тех микроводорослей, которые и так присутствуют в большинстве почв, в ряде случаев обусловливая «зеленый налет» на них, что коррелирует с повышением урожайности возделываемых сельскохозяйственных культур (Шалыго, 2019). Это достигается путем внесения в почву (или водную среду при режиме гидропоники) стимулирующих естественные культуры микроводоросли минеральных элементов (биогенов), а также улучшением рН, (например, известкованием почвы, ибо ее закисление подавляет рост в первую очередь полезных цианобактерий) и регулированием водного баланса почвы. Альтернативный подход представляет альголизация – обработка сельскохозяйственных растений культурами водорослей, их экстрактами или получаемыми из водорослей биологически активными добавками (БАД). Препараты микроводорослей вносятся в грунт до посева растений, при посеве вместе с семенами (или семена инкубируются в растворе, содержащем препараты микроводорослей) или на различных стадиях вегетации растений. Возможно также распыление этих препаратов для обработки листьев и других надземных органов растений (Шалыго, 2019; Guo et al., 2020; Bello et al., 2021). Микроводоросли, их биомасса и полученные из нее экстракты (в частности, при использовании растворителей под высоким давлением или с помощью сжиженной углекислоты как экстрагента) получили достаточно обширное применение при культивировании сельскохозяйственных растений, ибо они ускоряют прорастание семян и дальнейшее развитие этих растений. Например, экстракты микроводорослей стимулируют развитие проростков, побегов и корневых систем у различных овощных и зерновых культур, включая редис, салат, амарант, белокочанную и китайскую капусту, томат, перец, пшеницу, рис (Bello et al., 2021). Продемонстрирована связь между внесением био-удобрений на базе микроводорослей и улучшением утилизации растениями компонентов питательной среды (Garcia-Gonzalez, Sommerfeld, 2016), а также увеличением накопления растительной биомассы, что приводит к более высоким урожаям, например, у таких растений, как рис, чеснок, томат, пажитник (Ronga et al., 2019). В роли ускорителей роста растений успешно применялись разнообразные цианобактерии и зеленые микроводоросли, включая Acutodermis dimorphus, Arthrospira platensis, Anabaena azolla, Nostoc sp., Scenedesmus dimorphus, Chlorella vulgaris (Balasubramaniam et al., 2021). Внесение сухой биомассы Nannochloropsis spp., Ulothrix spp. и Klebsormidium spp. повышало концентрации сахаров и каротиноидов в плодах томата и улучшало качественные характеристики этих плодов. Био-удобрения на основе микроводорослей улучшали качество цветков розы, влияя на их каротиноидный состав и усиливая оранжевый или желтый цвет лепестков. Распыление полисахаридов, экстрагированных из культуры Arthrospira spp., на листья томата и перца увеличивали размер их плодов на 20 и 30% соответственно (Ronga et al., 2019). Культура Acutodermus dimorphus, ее экстракт и сухая биомасса стимулировали прорастание семян, рост растений и формирование цветков у томатов в условиях теплицы (Garcia-Gonzalez, Sommerfeld, 2016). Одной из наиболее часто используемых микроводорослей является хлорелла, которая активирует рост и повышает урожайность надземной части и зерна ячменя. Среди полезных эффектов хлореллы нельзя не отметить повышение содержания гуминовых кислот в почве (Шалыго, 2019). Суспензия культуры C. vulgaris стимулирует прорастание семян, удлинение побегов и корней, ветвление и формирование цветков у огурцов и томатов (Balasubramaniam et al., 2021). Прорастание и плодоношение Hibiscus esculentus были ускорены обработкой почвы и семян культурой C. vulgaris (Agwa et al., 2017). Смесь экстрактов C. vulgaris и Scenedesmus quadricauda стимулировала развитие корневой системы у проростков сахарной свеклы, культивируемых в водной среде (гидропоника) (Barone et al., 2018). Микроводоросли способствуют преодолению растениями различных стрессовых факторов, включая экстремальные (высокие и низкие) температуры, засуху, избыточное засоление среды, дефицит минеральных компонентов. Экстракты Arthrospira sp. и Chlorella sp. смягчают воздействие стресса, вызванного высокими концентрациями соли и повышают выживаемость растений пшеницы в стрессовых условиях. Вырабатываемый Dunaliella salina полисахарид снижает воздействие солевого стресса на растения томата, повышая концентрации в его тканях антиоксидантных ферментов, фенольных соединений, неофитадиена, токоферола, стигмастерола, 2,4-дитретбутилфенола– компонентов системы защиты растения от окислительного воздействия (El Arroussi et al., 2018; Bello et al., 2021). Важную роль играет способность многих цианобактерий, например, Anabaena sp., Nostoc sp., Oscillatoria sp., фиксировать азот из воздуха (Chittapun et al., 2018). Папоротник рода Azolla вступает в симбиоз с цианобактерией Anabaena azolla, и эта симбиотическая система способствует развитию культур риса, поскольку фиксирует до 120 кг азота на 1 гектар за вегетационный период. Внесение азотфиксирующих цианобактерий увеличивает плодородие хлопка на засоленных почвах. Комбинированное внесение культур цианобактерий родов Nostoc, Cylindrospermum, Anabaena на десятый день после посадки в теплице огурцов сорта Мирабела оптимизировало содержание азота и значение рН в почве, что приводило к стимуляции роста огурцов, увеличению числа их соцветий и количества плодов (Шалыго, 2019). Цианобактерии способны колонизовать различные ткани побегов и корневой системы, фиксируя азот и фосфор, выделяя сидерофоры для хелирования микроэлементов (железо, медь и др.) в доступной для растений форме и тем самым улучшая рост растений, стимулируя их защитные механизмы и повышая плодородие почв (Баулина, 2010; Balasubramaniam et al., 2021). Полезные эффекты микроводорослей (включая цианобактерии) как био-удобрений во многом связаны с их регуляторным действием на растения, так как они вырабатывают растительные гормоны и другие сигнальные вещества, включая ауксины, цитокинины, особенно цис-зеатин, преобладавший у изученных 24 видов зеленых микроводорослей (Ronga et al., 2019), гибберелины, бетаниол, этилен, брассиностероиды, салициловую и абсцизовую кислоты. Именно с подобным гормональным влиянием связывают стимуляторное действие, например, зеленой микроводоросли Scenedesmus spp. на развитие цветков, стеблей и листьев у петуньи, a цианобактерии Aulosira fertilissima – на развитие проростков риса (Ronga et al., 2019; Balasubramaniam et al., 2021). Как экологичная, экономичная и достаточно эффективная альтернатива химическим удобрениям, био-удобрения на основе микроводорослей все чаще появляются на мировом рынке. Примерами могут служить био-удобрения на основе Chlorella spp. под коммерческими названиями Terradoc® («Mikroalg Food and Agriculture Industries», Турция) и Terrasync® («Accelergy Corporation», США) (Balasubramaniam et al., 2021).
Микроводоросли и очистка сточных вод. Обработку сточных вод на основе водорослей можно рассматривать как пример фикоремедиации, которая выступает как экономически выгодная и экологически чистая биотехнология (Ahmad et al., 2020), составная часть более общего понятия фиторемедиация, определяемого как использование зеленых растений и связанных с ними микроорганизмов наряду с обработкой почвы и агрономическими методами для связывания, удаления или обезвреживания токсичных загрязняющих веществ окружающей среды (Das, 2018). Несколько условно процесс очистки муниципальных, индустриальных, аграрных сточных вод можно разделить на 4 этапа: 1) механический этап, очистка поступающих на очистные сооружения сточных вод с задержанием грубых и тонкодисперсных примесей c помощью решеток, сит, отстойников и др.; 2) биологический этап, очистка растворённой части загрязнений сточных вод биоценозом бактерий (наряду с простейшими и часто многоклеточным планктоном), который называется активным илом или биоплёнкой и потребляет растворенную органику, окисляя ее до нитратов и фосфатов, причем могут использоваться как аэробные, так и анаэробные бактерии, в зависимости от наличия или отсутствия кислорода воздуха в смеси активного ила и сточной воды; 3) физико-химический этап для доочистки от растворённых продуктов био-очистки – нитратов, фосфатов, остатков органических соединений, а также взвешенных веществ (используя флотацию, сорбцию, ионообменную очистку и другие методы); 4) дезинфекция сточных вод с ликвидацией патогенных микроорганизмов, например, с помощью ультрафиолетового облучения (Das, 2018; Molazadeh et al., 2019; Ahmad et al., 2020). Внесение микроводорослей имеет значительный потенциал в плане модификации и, возможно, объединения этапов 2 и 3. На этапе био-очистки (этап 2), а именно аэробной очистки от органических веществ и нитрификации (окисления органических загрязнений и аммонийного азота), необходимый кислород традиционно подается с помощью аэратора. Замена аэратора фотосинтезирующими микроводорослями превращает аппарат для очистки сточных вод в высоко рентабельную, легко контролируемую систему очистки муниципальных и промышленных стоков от органики, что особенно актуально в ряде тропических стран, где нет постоянного снабжения электроэнергией (Molazadeh et al., 2021). В частности, предполагается использовать стабилизационные, или накопительные, пруды для водоочистки (Waste Stabilization Ponds, WSP), в которых сточные воды обрабатываются комбинированными культурами бактерий и микроводорослей. Вырабатываемый водорослями при освещении кислород используется бактериями для расщепления органики, что характеризуется снижением интегрального параметра – биохимической потребности в кислороде (Biochemical Oxygen Demand, BOD). Как уже отмечено, необходим и анаэробный режим био-очистки, для чего используется дополнительный пруд с гетеротрофными бактериями (Das, 2018; Molazadeh et al., 2019; Ahmad et al., 2020). Модификацией кратко описанной технологии служит высокоскоростной водорослевый пруд. Система содержит фотобиореактор для выращивания водорослей и собственно окислительный пруд, где микроводоросли генерируют кислород, а бактерии не только разлагают органику, но и приводят минеральные компоненты в доступную для усвоения микроводорослей форму, в частности, превращая аммонийный азот в форму нитрата (это уже этап 3, см. выше). В данной системе предпочтительно использование нитчатых микроводорослей (Oscillatorium, Arthrospira) или образующих клеточные колонии (ценобии, р. Scenedesmus), биомасса которых легче отделяется, нежели у мелкоклеточных видов Chlorella sp. или Oocystis sp. (Molazadeh et al., 2019). Особой толерантностью к органическим загрязнителям в сточных водах обладают представители родов Euglena, Oscillatoria, Chlamydomonas, Scenedesmus, Chlorella, Nitzschia, Navicula, Stigeoclonium (Molazadeh et al., 2019). Помимо снабжения активного ила кислородом на этапе разложения органики, микроводоросли непосредственно участвуют в этом процессе, расщепляя опасные органические загрязнители. Так, краситель анилин, применяемый в текстильной и пищевой промышленности, взаимодействует с реакционноспособными участками клеточной стенки микроводорослей, что приводит к его нейтрализации (Balasubramaniam et al., 2021). Вследствие деятельности фармацевтической и косметической индустрии, сточные воды обогащаются поверхностно-активными веществами, гормонами, антибиотиками, пластификаторами, жаропонижающими и противогрибковыми препаратами, а также антидепрессантами и другими психотропными средствами, проникающими в естественные водоемы. Предполагается, что «широкий спектр водных организмов, включая бактерии, водоросли, беспозвоночных и рыб, имеют рецепторы» к подобным нейроактивным поллютантам, что и обусловливает их чувствительность к таким соединениям (Rosi-Marchall et al., 2015). В частности, такие широко применяемые психофармакологические препараты как прозак (антидепрессант) и амфетамин (стимулятор когнитивных способностей) вызывают серьезные изменения в сообществах бактерий и водорослей в составе водных экосистем, эти же вещества влияют на скорость роста насекомых (Learn, 2018). Микроводоросли способны полностью или частично разрушать фармакологические препараты и другие органические поллютанты. В лабораторных условиях с использованием открытых прудов и колонных фотобиореакторов с барботерами было показано, что микроводоросли способны удалять из воды антибиотики метопролол, триклозан, а также салициловую кислоту (более чем на 90% их исходной концентрации) (Tolboom et al., 2019). Микроводоросли Chlorella sp. и Scenedesmus sp. способны очищать воду от фенольных соединений; так Chlorella pyrenoidosa разрушает в среднем 97,4% фенола при его исходной концентрации до 0,8 г/л (Dayana Privadharshini, Bakthavatsalam, 2019; Leng et al, 2020). Микроводоросли выполняют также функции указанного выше этапа 3 очистки сточных вод вместо физико-химических методов (или наряду с ними): микроводоросли способны полностью очищать воду от азота и фосфора, утилизируя эти элементы, причем речь идет о ионообменной технологии «двойного эффекта»: кроме очистки сточных вод, получается ценная биомасса микроводорослей, варианты применения которой мы уже рассмотрели выше (Balasubramaniam et al., 2021). Даже при низкой температуре группа исследователей успешно применила культуру микроводоросли штамма UHCC00027 для снижения до допустимых значений концентраций N и P в сточных водах. Полученная биомасса микроводоросли была иcпользована с целью производства топлива (биодизеля, см. выше). Правда, избыток НЖК в биомассе препятствовал удовлетворению международных стандартов для биодизеля (Jämsä et al., 2017). Помимо азота и фосфора, микроводоросли эффективно очищают воду от других неорганических веществ, например от соединений серы и селена и, что особенно важно, тяжелых металлов, включая цинк, медь, свинец, ртуть, хром, кадмий, никель, железо, марганец, ванадий (Ahmad et al., 2020). В то же время, микроводоросли могут применяться для концентрирования и получения из раствора ценных металлов (золота, серебра), наконец, для сорбции радиоактивных веществ (радионуклидов). Существенным сродством к поливалентным ионам металлов и соответственно большим практическим потенциалом обладают представители р. Chlorella и Scenedesmus – «микроводоросли выбора» для очистки воды от металлов (Ahmad et al., 2020). Сказанное не означает невнимания к другим микроводорослям. Так, хром эффективно удаляется из воды цианобактериями Oscillatoria spp., свинец – зелеными водорослями Chlamydomonas spp. Однако многие металлы лучше всего сорбируются уже упомянутыми распространенными биотехнологическими объектами – Chlorella vulgaris эффективно связывает кадмий, медь и цинк, а Scenedesmus chlorelloides – молибден (Molazadeh et al., 2019). Микроводоросли обладают двумя механизмами удаления тяжелых металлов из воды: 1) пассивная, независимая от клеточного метаболизма, сорбция металлов поверхностными структурами клеток, дополняемая их хелатированием, комплексообразованием, микроосаждением за счет выделяемых клетками реагентов; 2) активный энергозависимый транспорт ионов металлов внутрь клетки. Если активный транспорт требует снабжения культуры водорослей необходимыми элементами и благоприятных для них значений температуры и рН, то пассивная сорбция не нуждается в усилиях по поддержанию активного метаболизма клеток. Она может осуществляться отмершими клетками («пассивной биомассой»), которую можно предварительно обработать физическим или химическим путем для повышения эффективности сорбции металлов или иных загрязнителей (Ahmad et al., 2020). Будущее развитие технологии очистки сточных вод путем фикоремедиации связано с применением генетической инженерии и протеомики ради создания высокорентабельных систем, в которых действующие микроводоросли отличались бы высоким сродством к загрязнителям и избирательностью их сорбции или метаболизма. Многообещающей биотехнологией является также иммобилизация клеток микроводорослей, особенно путем их включения (инкапсуляции) в синтетические (полиакриламид) или природные, в том числе синтезируемые водорослями полимерные гели (альгинат, каррагинан, агар-агар). Ожидается, что иммобилизация повысит фотосинтетическую активность и сорбционную способность водорослей, их устойчивость к неблагоприятным условиям, а также приведет к их более компактному расположению в биореакторе или пруду и тем самым к экономии территории (Ahmad et al., 2020: Balasubramaniam et al., 2021).
Микроводоросли и косметические средства. Косметические средства включают в себя продукты, направленные на улучшение структуры, морфологии и внешнего вида кожи с помощью вспомогательных веществ и активных ингредиентов, адаптированных к различным типам кожи (нормальная, жирная, комбинированная, чувствительная и т.д.) (Mourelle et al., 2017). К косметическим препаратам на базе микроводорослей следует отнести их экстракты (например, для обтирания клиентов в салонах красоты), альгиновые кислоты (применяемые в виде масок), а также эфирные масла. «Водорослевая» косметика приобретает популярность в настоящее время, и это связано с эффективностью микроводорослей в качестве увлажняющих кожу (или напротив, удаляющих лишнюю жидкость в роли дренажа), уплотняющих, пигментирующих (окрашивающих), омолаживающих, отбеливающих кожу, солнцезащитных средств (Варфоломеев, Вассерман, 2011; Mourelle et al., 2017). Компоненты микроводорослей добавляют в кремы для лица и рук, омолаживающие мази, смачивающие, снимающие кожное раздражение, освежающие препараты, солнцезащитные лосьоны, средства по уходу за волосами (Bilal et al., 2017; Mourelle et al., 2017). К числу наиболее часто используемых в косметике видов микроводорослей относятся Arthrospira sp., Chlorella vulgaris, Dunaliella salina, Chondrus crispus, Mastocarpus stellatus, Ascophyllum nodosum, Nannochloropsis oculata (Bilal et al., 2017). Изготовлением косметических средств из микроводорослей заняты ныне крупные компании, такие как «Louis Vuitton Moёt Hennessy» и «Danial Jouvance» (Франция), «AGI Dermatics» (США). Примером является производимый компанией «Codif» (Франция) продукт Dermochlorella – экстракт Chlorella vulgaris, стимулирующий синтез коллагена как составной части структурной основы (матрикса) кожи и способствующий регенерации кожной ткани и разглаживанию морщин (Mourelle et al., 2017) Каротиноиды микроводорослей применяются как красители в косметике, наряду с хлорофиллами и фикобилипротеинами (об этих пигментах см. раздел о пищевых применениях водорослей выше), которые придают косметическим средствам разные оттенки зеленого, синего, желтого, оранжевого, красного, фиолетового, коричневого и служат альтернативой синтетическим красителям. Красный каротиноидный пигмент астаксантин, характерный для Haematococcus pluvialis, обладает сильным антиоксидантным эффектом, превосходя примерно в 10 раз b-каротин и зеаксантин и в 100 раз – токоферол. Синтезируемый Dunaliella salina каротиноид b-криптоксантин, кроме антиокисдантного действия, стимулирует образование в коже гиалуроновой кислоты и поэтому рассматривается как средство, противодействующее старению кожи (Mourelle et al., 2017; Balasubramaniam et al., 2021). Кроме создания различных оттенков зеленого цвета, хлорофиллы обладают также дезодорирующим действием (маскируя неприятные запахи) и находят применение в зубных пастах и гигиенических изделиях. Флуоресцентные фикобилипротеины (фикоэритрин, фикоцианин и др.) используются в составе губных помад, теней для век и других косметических средств (Mourelle et al., 2017; Balasubramaniam et al., 2021). Помимо колорантов, пигменты водорослей находят применение в косметике в составе средств для загара. Каротиноид кантаксантин, характерный для Chlorella sp., Haematococcus sp., Nannochloropsis sp., способствует эффекту загара, поскольку этот красно-оранжевый пигмент откладывается в коже и подкожном жире, придавая коже более темный оттенок. Еще один пигмент, скитонемин (димерный алкалоид), может применяться в составе косметики солнцезащитного действия, обладая сильным антиоксидантным, УФ-протекторным действием. Отбеливающее действие косметических препаратов по отношению к человеческой коже характерно для средств из биомассы микроводорослей Haematococcus pluvialis и Nannochloropsis oculata. Отбеливающий эффект обусловлен ингибированием активности тирозиназы, которая необходима для синтеза кожного пигмента меланина. Тирозиназу ингибируют выделенные из указанных водорослей астаксантин и зеаксантин (Mourelle et al., 2017; Balasubramaniam et al., 2021). Содержащиеся в микроводорослях полисахариды характеризуются смачивающим действием, необходимым для поддержания эластичности кожи и ее блеска, для предотвращения преждевременного старения кожи и формирования морщин (Wang et al., 2015). Следует особо отметить роль характерного для водорослей р. Chlorella, Skeletonema, Porphyridium, Nostoc b-1,3-глюкана, который также отличается антиоксидантным, иммуностимулирующим и противовоспалительным эффектом (Mourelle et al., 2017; Balasubramaniam et al., 2021).
Медицинские приложения биотехнологии микроводорослей. Микроводоросли и получаемые из них препараты представляют экологически ценную альтернативу фармакологическим средствам, полученным путем химического синтеза. Микроводоросли – многообещающие средства лечения и профилактики серьезных недугов современного мира: диабета, ожирения (и противоположной крайности – анорексии и исхудания), болезней сердца и сосудов, рака, инсульта, болезней Альцгеймера и Паркинсона, деменции. Они также часто являются эффективными антибактериальными, противогрибковыми и антивирусными агентами. Уже отчасти были обсуждены присущие многим микроводорослям антиоксидантные, фотопротекторные, гелеобразующие, увлажняющие, антистрессорные, омолаживающие, противовоспалительные и другие ценные свойства. Это связано с наличием у них полисахаридов (в том числе сульфатированных), каротиноидов (особенно b-каротина, астаксантина, зеаксантина и др.), фикобилипротеинов (у цианобактерий), липидных компонентов (особенно НЖК), витаминов, биогенных аминов (катехоламины, серотонин, гистамин, ацетилхолин) и многих других химических соединений (Варфоломеев, Вассерман, 2011; Mourelle et al., 2017; Sathasivam, Ki, 2018; Sathasivam et al., 2019; Choo et al., 2020; Balasubramaniam et al., 2021; Sompura et al., 2021). Способность представителей р. Chlorella, Arthrospira и целого ряда других таксономических групп микроводорослей стимулировать развитие нормальной микробиоты желудочно-кишечного тракта и других ниш в организме человека и поэтому положительно влиять на его телесное и психическое здоровье позволяет рассматривать соответствующие виды микроводорослей в качестве кандидатов на роль пробиотиков нового поколения – так они интерпретируются в работах последних лет (Шендеров и др., 2017; Oleskin, Shenderov, 2019, 2020; Олескин и др., 2020; Shenderov et al., 2020). Медицинские аспекты биотехнологии микроводорослей подробно рассмотрены в самостоятельной обзорной работе (Олескин, Боян, 2022). Таким образом, настоящая работа подытоживает актуальные данные, полученные в лабораториях всего мира, и рассматривает, каким образом микроводоросли и их продукты удовлетворяют требованиям, предъявляемым в настоящее время к объектам биотехнологии, включая получение пищевых добавок, кормов для животных, косметических средств, лекарственных препаратов, биологических удобрений, биотоплива, а также очистку сточных вод (биоремедиацию).
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данном сообщении.
Список литературы
Статья поступила в редакцию 16.07.2022
Об авторах Олескин Александр Владимирович – Alexander V. Oleskin доктор биологических наук oleskiny@yandex.ru Цао Боян – Tsao Boyang Совместный университет МГУ-ППИ, Шэньчжэнь, Китай (Shenzhen MSU-BIT University, Shenzhen, China) caoby@smbu.edu.cn Корреспондентский адрес: Россия, 119234, г. Москва, Ленинские горы, д. 1, стр. 12, Биологический факультет МГУ. Телефон (495)-939-27-64.
ССЫЛКА: Олескин А.В., Цао Боян. Микроводоросли как биотехнологические объекты // Вопросы современной альгологии. 2022. №3 (30). С. 1–23. URL: http://algology.ru/1839 DOI – https://doi.org/10.33624/2311-0147-2022-3(30)-1-23 EDN – RSMJZQ
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
Microalgae in terms of modern-day biotechnology Alexander V. Oleskin1, Cao Boyang2 1Lomonosov Moscow State University (Moscow, Russia) Green, red, brown, and diatomic algae, as well as cyanobacteria, have been in the focus of attention of scientists and technologists for over five decades. This is due to their importance in the capacity of efficient and economical producers of food additives, cosmetics, pharmaceuticals, biofertilizers, biofuels, and wastewater bioremediation agents. The present work deals with global recent relevant developments and addresses the question whether microalgae and their products can meet new challenges in terms of cutting-edge biotechnological developments based on synthetic biology, phenomics, and the Internet of Things (IoT). Key words: microalgae; aquatic ecosystems; biotechnology; biofuel; functional nutrition; biological fertilizers; wastewater treatment; bioremediation; cosmetics; pharmacology; synthetic biology; phenomics, IoT
References
Authors Oleskin Alexander V. ORCID – https://orcid.org/0000-0002-6816-1615 Lomonosov Moscow State University, Moscow, Russia oleskiny@yandex.ru Cao Boyang Shenzhen MSU-BIT University, Shenzhen, China caoby@smbu.edu.cn
ARTICLE LINK: Oleskin A.V., Cao Boyang. Microalgae in terms of modern-day biotechnology. Voprosy sovremennoi algologii (Issues of modern algology). 2022. № 3 (30). P. 1–23. URL: http://algology.ru/1839 DOI – https://doi.org/10.33624/2311-0147-2022-3(30)-1-23 EDN – RSMJZQ When reprinting a link to the site is required Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor, please and we send it to you with pleasure for free.
На ГЛАВНУЮ
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ
|
|||
|
| ||