|
|
|
|
с международным участием «Водоросли: проблемы таксономии и экологии, использование в мониторинге и биотехнологии» (12–18 сентября 2022, Москва, Россия) Оптимизация метода фиксации пресноводных микроводорослей (Scenedesmaceae, Chlorophyta) для первичной идентификации с использованием сканирующей электронной микроскопии
Чубчикова И.Н., Дробецкая И.В., Данцюк Н.В., Челебиева Э.С. Irina N. Chubchikova, Irina V. Drobetskaya, Natalia V. Dantsyuk, Elina S. Chelebieva Федеральный исследовательский центр «Институт биологии южных морей
УДК 582.263:57.086
На примере зеленых микроводорослей семейства Scenedesmaceae (Coelastrella rubescens, Coelastrella sp., Coelastrella aeroterrestrica, Pseudospongiococcum protococcoides и Desmodesmus sp.) опробованы различные методы фиксации для сканирующей электронной микроскопии с целью получения изображений, отражающих таксономически значимые морфологические особенности клеточной оболочки (ребра, полюса, шипы, бородавки и т.д.). В зависимости от физиологического состояния клеток (молодые, активно делящиеся или на стадии вторичного каротиногенеза) для фиксации использовали 0,5–2,5% глутаровый альдегид в 0,15 М PBS, а также в 5,0 и 6,67 мМ фосфатном буфере, при значениях рН в диапазоне 6,8–7,4. Дегидратацию проводили в градуированном этаноле (20–100%). Показана высокая информативность метода СЭМ для идентификации Scenedesmaceae со структурированной клеточной оболочкой. Ключевые слова: Coelastrella rubescens; Coelastrella sp.; Coelastrella aeroterrestrica; Desmodesmus sp.; Pseudospongiococcum protococcoides; сканирующая электронная микроскопия; глутаровый альдегид
Введение Для почвенно-аэрофитных Scenedesmaceae, обитающих в условиях постоянных резких изменений температуры, влажности, инсоляции и содержания питательных элементов, характерна значительная фенотипическая пластичность клеток (Baudelet et al., 2017, Goecke et al., 2020). В сочетании с относительно простой морфологией клеток это затрудняет определение таксономического статуса видов стандартными методами световой микроскопии. Многие представители сценедесмальных микроводорослей интересны с биотехнологической точки зрения как перспективные источники липидов и кетокаротиноидов (ККар) группы астаксантина (Minyuk et al., 2017), что обуславливает активный поиск и выделение новых штаммов-продуцентов из природных биотопов (поверхность почв и скальных пород, кора деревьев, лужи, солоноватые и мелкие пресные водоемы). Следует отметить, что морфологическая изменчивость клеток микроводорослей в условиях лабораторной культуры иногда выходит за пределы установленной по природным образцам. Тем не менее, каждый вид имеет свои таксономически значимые морфологические признаки, остающиеся неизменными независимо от внешних условий и стадии жизненного цикла. Самый наглядный признак принадлежности объекта исследования к определенной таксономической группе – это структура наружной клеточной оболочки: наличие ребер, полюсов, шипов, бородавок и др., что характерно для микроводорослей семейства Scenedesmaceae. Особенности рельефа оболочки, отчетливо видимые на СЭМ-изображениях, могут служить дополнительным критерием для интегративного метода идентификации вида или штамма. Это важно при неоднозначных результатах построения филогенетического древа на основе секвенирования гена 18S рДНК и последовательностей ITS2 из-за ограниченной видоспецифичности этих критериев. Целью данной работы было подобрать адекватный метод фиксации микроводорослей для СЭМ-микрографии, максимально сохраняющий прижизненную морфологию клеток. Полученные СЭМ-снимки могут облегчить идентификацию видов, а также служить для иллюстрации каталога коллекции живых культур каротиногенных микроводорослей (Данцюк и др., 2021).
Материалы и методы В работе были использованы штаммы из рабочей коллекции живых культур каротиногенных микроводорослей Института биологии южных морей им. А.О. Ковалевского РАН. В настоящее время коллекция насчитывает 70 штаммов и пополняется за счет направленного межколлекционного обмена с ведущими российскими и зарубежными коллекциями и собственных полевых сборов в причерноморских зонах Крыма и Кавказа. Штаммы Coelastrella sр. (IBSS-109), Coelastrella rubescens Kaufnerová & Eliás (IBSS-12), неподтвержденный штамм сf Coelastrella aeroterrestrica Tschaikner, Gärtner & Kofler (Тр1 Шамиль), Pseudospongiococcum protococcoides Gromov & Mamkaeva (IBSS-10) и Desmodesmus sp. (IBSS-112) были получены в различные годы путем межколлекционного обмена. Desmodesmus sp. изначально поступил в нашу коллекцию как штамм Coelastrella sp., но СЭМ-изображения позволили предположить его принадлежность к роду Desmodesmus. Этот штамм нуждается в более точном определении его таксономического статуса, что будет сделано в дальнейшем. Культура P. protococcoides с 2008 г. используется нами в экспериментах (Чубчикова и др., 2009), до того этот вид упоминался лишь как коллекционный штамм (Громов, Титова, 1988). СЭМ-изображения клеток этого вида, представленные в данной работе, являются впервые полученными, и в сочетании с результатами молекулярно-филогенетического анализа позволяют предварительно установить принадлежность P. protococcoides к семейству Scenedesmaceae (Челебієва, Скребовська, 2013). Исследуемые штаммы Scenedesmaceae сравнительно мелкоклеточные, округлой или эллипсообразной формы. Оболочки двухслойные: за плазматической мембраной следуют целлюлозный и внешний триламинарный слои (Goecke at al., 2020). В неблагоприятных условиях происходит уплотнение триламинарного компонента клеточной стенки за счет сопряженных процессов синтеза ККар и негидролизуемого полимера спорополленина. Режим фиксации подбирали для культур трех возрастов: молодых клеток, недавно вышедших из спорангиев, клеток на экспоненциальной фазе роста и клеток на стадии вторичного каротиногенеза (ВКГ). Образцы культур получали тремя способами.
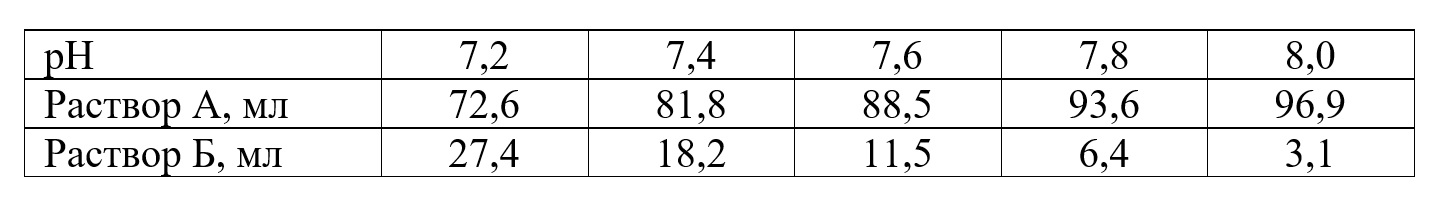
Методы фиксации Предложенные в работе протоколы фиксации являются результатом анализа литературных источников, содержащих методику пробоподготовки сценедесмальных к СЭМ, перечислить которые не позволяет ограниченный объем публикации. На основании их анализа были предложены 6 вариантов пробоподготовки клеток сценедесмальных, исключающие применение распространенных в практике фиксации соединений (поли-L-лизина, формальдегида, тетраоксида осмия, марганцовокислого калия и др.), часто высокотоксичных или канцерогеных. Фиксатором клеток служил глутаровый альдегид (ГА), один из наиболее эффективных белок-сшивающих химических агентов (Migneault et al., 2004). Фиксирующий реагент получали разбавлением ГА буфером до концентраций от 0,5 до 2,5%. Для разбавления использовали два типа буфера. Первый – стандартный фосфатно-солевой PBS-буфер в концентрации 0,15 М. Второй – Na-К-фосфатный буфер (ФБ), не содержащий хлоридов, приготовленный по схеме, рекомендованной (Немировский, 2022), в концентрации 0,0667 М из маточных растворов А и Б: А – 9,47 г Na2HPO4 в 1 л воды; Б – 9,08 г КН2РО4 в 1 л воды. Буферы с требуемыми значениями рН получали смешиванием растворов А и Б в количествах, указанных в табл. 1.
Таблица 1. Приготовление Na-К-фосфатного буфера с требуемыми значениями рН Table 1. Preparation of Na-K-phosphate buffer with required pH values
Разбавлением 0,0667 М ФБ получали буферы с концентрациями 5,0 и 6,67 мM, осмолярность которых соответствует осмолярности среды ВВМ (13–15 мОсм∙л-1). Значения рН разбавленных ФБ (ФБразб.) отличаются от указанных в табл. 1 приблизительно на 0,2 за счет снижения буферной емкости при высокой степени разведения слабокислым дистиллятом. Добавление ГА, имеющего кислую природу, также незначительно подкисляет смесь. Кроме того, реакция сшивания белков ГА сопровождается выделением в среду ионов водорода, т.е. снижением значения pH. С поправкой на это выбирали ФБ с определенным значением рН, обеспечивая нейтрально-слабощелочной диапазон рН (6,8–7,4) фиксирующего реагента, способствующий образованию прочных, практически необратимых белковых сшивок. Поскольку ГА не способен фиксировать липиды, в том числе мембранные, и сохранять их интактными в процессе дальнейшей дегидратации этанолом (Migneault et al., 2004), в соответствующих вариантах проводили постфиксацию в 0,005% растворе Люголя (Auinger et al., 2008). Обобщенная схема пробоподготовки заключалась в отборе аликвоты культуры с численностью 5·106–1·107 кл·мл-1, центрифугировании (Eppendorf Centrifuge 5810) при 600–800 g, удалении супернатанта, промывке пробы соответствующим буфером с последующим центрифугированием, добавлении к осадку фиксирующего (или постфиксирующего) реагента. Время экспозиции (в темноте при 4°С) варьировало в зависимости от выбранного режима фиксации. Для перемешивания проб использовали Microspin FV-2400, Biosan. После каждого этапа пробы центрифугировали при 600–800 g и отмывали буфером (трижды) и дистиллятом. В работе использовали различные варианты фиксации клеток (табл. 2).
Таблица 2. Протоколы фиксации клеток Table 2. Protocols for cell fixation
Последующую дегидратацию клеток проводили при 4°C в серии возрастающих концентраций этанола (20, 30, 50, 75, 96 и дважды 100%) по 10 мин для каждой. Образцы высушивали в режиме мягкой сушки (2,5 часа) в критической точке CO2 (Leica EM CPD300, Германия). Для напыления (Au/Pd, 0,5–1,0 мин) применяли Leica EM ACE200 (Германия). СЭМ-изображения клеток получали с помощью сканирующего электронного микроскопа Hitachi SU3500.
Результаты и обсуждение Фиксация молодых клеток Scenedesmaceae. Молодые клетки, имеющие тонкую оболочку, при обработке оказались наиболее уязвимыми. Использование PBS-буфера в фиксирующем реагенте привело к сморщиванию клеток (рис. 1 а–в) из-за его высокой осмолярности, на порядок превышающей таковую у среды ВВМ. При замене PBS на ФБразб. деформация молодых клеток значительно уменьшилась, причем лучше выглядели клетки, только что вышедшие из спорангиев или находящиеся в плотных скоплениях (рис. 1 г–з).
Fig. 1. Young cells of Scenedesmaceae: a – C. rubescens IBSS-12, protocol №1; б – Coelastrella sр. IBSS-109, protocol №1; в – Desmodesmus sp. IBSS-112, protocol №2;
На снимках отчетливо виден таксономически значимый рельеф: шипы и бородавки у Desmodesmus sp. IBSS-112, а также апикальные полюса и продольные меридиональные ребра у C. rubescens IBSS-12, Coelastrella sр. IBSS-109 и P. protococcoides. Фиксация клеток Scenedesmaceae в стадии активного деления (экспоненциальной фазе). На 4–9 сутки клетки увеличиваются в размерах, их оболочка утолщается и меньше деформируется, несмотря на осмотический стресс, вызванный применением PBS (рис. 2 а–д), причем более крупные клетки Coelastrella sр. IBSS-109 лучше сохраняют форму и структуру оболочки, чем клетки мелкоклеточного штамма C. rubescens IBSS-12. Замена 0,15 М PBS на ФБразб. концентрацией 6,67 мМ или 5 мМ позволяет сохранить рельеф наружной оболочки и форму клеток практически без искажений (рис. 2 е–м). При формировании спорангиев у C. rubescens, Coelastrella sр., C. aeroterrestrica и P. protococcoides оболочка растягивается, ребра становятся малочисленными и менее заметными, что значительно затрудняет их идентификацию на этой стадии (рис. 2 е, ж, к), тогда как делящиеся клетки Desmodesmus sp. сохраняют характерные шипы и бородавки (рис. 2 л, м).
Рис. 2. Клетки Scenedesmaceae в фазе активного деления: а – C. rubescens IBSS-12, протокол №2; Fig. 2. Cells of Scenedesmaceae in active division phase: а – C. rubescens IBSS-12, protocol №2;
Фиксация клеток Scenedesmaceae на стадии ВКГ. На этой стадии клеточная оболочка каротиногенных Scenedesmaceae утолщается, в цитоплазме, в липидных включениях в значительных количествах накапливаются вторичные Кар. Для плотных толстостенных клеток осмолярность фиксирующего реагента не имеет решающего значения, и они практически не деформируются (рис. 3).
Рис. 3. Клетки Scenedesmaceae на стадии вторичного каротиногенеза: Fig. 3. Cells of Scenedesmaceae at secondary carotenogenesis stage:
Клетки исследуемых видов сохраняют способность к делению и на стадии ВКГ, при этом оболочки спорангиев сильно растянуты и ребра слабо выражены, а молодые мелкие клетки хорошо сохраняют форму и характерный рельеф наружной оболочки.
Заключение Качество СЭМ-изображений клеток исследуемых видов на различных стадиях развития культуры зависит от двух параметров фиксирующего реагента: осмолярности и значения рН. Для определения таксономического статуса вида или штамма следует анализировать СЭМ-изображения клеток на экспоненциальной стадии роста, наружные оболочки которых имеют наиболее четко выраженную рельефную структуру (полюса и меридиональные ребра у Coelastrella rubescens, Coelastrella sp., Coelastrella aeroterrestrica и Pseudospongiococcum protococcoides, шипы и бородавки у Desmodesmus sp.). Наилучший результат дает использование 0,5% ГА в 5 мM ФБразб. (протокол №5), а для клеток стадии ВКГ – 2% ГА в 6,67 мМ ФБразб с постфиксацией 0,005% раствором Люголя (протокол №6). Отдельно необходимо отметить, что впервые были получены СЭМ-изображения для Pseudospongiococcum protococcoides.
Работа выполнена в соответствии с планом научно-исследовательской работы ФИЦ «ИнБЮМ им. А.О.Ковалевского» в рамках темы № 121030300149-0 «Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса». Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данном сообщении.
Список литературы
Статья поступила в редакцию 26.05.2022 Об авторах Чубчикова Ирина Николаевна – Irina N. Chubchikova младший научный сотрудник, ФИЦ «Институт биологии южных морей имени А.О.Ковалевского РАН» - ФИЦ ИнБЮМ РАН, Севастополь, Россия (FIC “Kovalevsky Institute of Marine Biological Research RAS”, Sevastopol, Russia), Отдел физиологии животных и биохимии chubchikova@mail.ru Дробецкая Ирина Викторовна – Irina V. Drobetskaya научный сотрудник, ФИЦ «Институт биологии южных морей имени А.О.Ковалевского РАН» - ФИЦ ИнБЮМ РАН, Севастополь, Россия (FIC “Kovalevsky Institute of Marine Biological Research RAS”, Sevastopol, Russia), Отдел физиологии животных и биохимии drobetzkaya@mail.ru Данцюк Наталья Викторовна – Natalia V. Dantsyuk научный сотрудник, ФИЦ «Институт биологии южных морей имени А.О.Ковалевского РАН» - ФИЦ ИнБЮМ РАН, Севастополь, Россия (FIC “Kovalevsky Institute of Marine Biological Research RAS”, Sevastopol, Russia), Отдел физиологии животных и биохимии nterent@mail.ru Челебиева Элина Сергеевна – Elina S. Chelebieva старший научный сотрудник, ФИЦ «Институт биологии южных морей имени А.О.Ковалевского РАН» - ФИЦ ИнБЮМ РАН, Севастополь, Россия (FIC “Kovalevsky Institute of Marine Biological Research RAS”, Sevastopol, Russia), Лаборатория экологической иммунологии гидробионтов elina.chelebieva@gmail.com Корреспондентский адрес: Россия, 299053, г. Севастополь, пр-т Нахимова, 2, ИнБЮМ; тел. (8692)-55-07-95.
ССЫЛКА: Чубчикова И.Н., Дробецкая И.В., Данцюк Н.В., Челебиева Э.С. Оптимизация метода фиксации пресноводных микроводорослей (Scenedesmaceae, Chlorophyta) для первичной идентификации с использованием сканирующей электронной микроскопии // Вопросы современной альгологии. 2022. №1 (28). С. 102–109. URL: http://www.algology.ru/1818 DOI – https://doi.org/10.33624/2311-0147-2022-1(28)-102-109 EDN – VYUXDD При перепечатке ссылка на сайт обязательна
Optimization of freshwater microalgae (Scenedesmaceae, Chlorophyta) fixation method for primary taxonomic identification Irina N. Chubchikova, Irina V. Drobetskaya, Natalia V. Dantsyuk, Elina S. Chelebieva Kovalevsky Institute of Marine Biological Research RAS (Sevastopol, Russia)
On the example of green microalgae of the family Scenedesmaceae Coelastrella rubescens, Coelastrella sp., Coelastrella aeroterrestrica, Pseudospongiococcum protocols and Desmodesmus sp. different fixation methods were tested for scanning electron microscopy in order to obtain images of taxonomically relevant cell surface structures (ribs, poles, spines, warts, etc.). Depending on the physiological state of the cells (young, actively dividing or at the secondary carotenogenesis stage), 0.5–2.5% glutaraldehyde in 0.15 M PBS, as well in 5 and 6.67 mM phosphate buffer, were used for fixation. The pH range of the fixing reagent was 6,8–7,4. Dehydration was performed in graduated ethanol (20–100%). It was concluded that the SEM method is highly informative for the identification of Scenedesmaceae with a structured cell wall. Key words: Coelastrella rubescens; Coelastrella sp.; Coelastrella aeroterrestrica; Desmodesmus sp.; Pseudospongiococcum protococcoides; scanning electron microscopy; glutaraldehyde
References
Authors Chubchikova Irina N. ORCID – https://orcid.org/0000-0002-6601-7134 Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia chubchikova@mail.ru Drobetskaya Irina V. ORCID – https://orcid.org/0000-0002-0217-8801 Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia drobetzkaya@mail.ru Dantsyuk Natalia V. ORCID – https://orcid.org/0000-0003-0365-917X Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia nterent@mail.ru Chelebieva Elina S. ORCID – https://orcid.org/0000-0002-7662-2573 Kovalevsky Institute of Marine Biological Research RAS, Sevastopol, Russia elina.chelebieva@gmail.com
ARTICLE LINK: Chubchikova I.N., Drobetskaya I.V., Dantsyuk N.V., Chelebieva E.S. Optimization of freshwater microalgae (Scenedesmaceae, Chlorophyta) fixation method for primary taxonomic identification by scanning electron microscopy. Voprosy sovremennoi algologii [Issues of modern algology]. 2022. №1 (28). P. 102–109. URL: http://www.algology.ru/1818 DOI – https://doi.org/10.33624/2311-0147-2022-1(28)-102-109 EDN – VYUXDD When reprinting a link to the site is required Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free.
На ГЛАВНУЮ
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ
|
|||
|
| ||