|
|
|
|
с международным участием «Водоросли: проблемы таксономии и экологии, использование в мониторинге и биотехнологии» (12–18 сентября 2022, Москва, Россия) Диатомовые бентоса Черного моря: редкие, инвазивные, «воскресшие» виды и оценка их таксономической исключительности
Неврова Е.Л. Elena L. Nevrova
ФИЦ «Институт биологии южных морей им. А.О. Ковалевского РАН» УДК [582.261.1:574.587.06](262.5)
Оценка разнообразия бентосных диатомовых необходима для сохранения генетического фонда, особенно для редких и исчезающих видов. Флора Bacillariophyta Черного моря насчитывает 1100 видов и ввт, среди которых виды-реликты, аборигены, пресноводные, интродуценты и вселенцы, акклиматизирующиеся к иным условиям. Выявлено 8 новых для флоры родов, свыше 280 новых находок, ряд видов, не регистрируемых в Мировом океане в ХХ в. Выделены значимые для сохранения группы из 33 и 11 видов с соответствующим рангом высокой и наивысшей таксономической исключительности. Вид, образующий моновидовую ветвь на иерархическом древе, приоритетен для сохранения по сравнению с видами, формирующими поливидовую ветвь. Исчезновение видов с высоким рангом приводит к значительным изменениям в структуре флоры, поэтому поддержание неизменности условий обитания является первоочередной мерой для сохранения разнообразия Bacillariophyta. Ключевые слова: Bacillariophyta; Крым; донные диатомовые; разнообразие; индекс таксономической отличительности
Бентосные диатомовые водоросли являются ключевым звеном в функционировании морских экосистем, поэтому актуальность изучения и сохранения их биоразнообразия возрастает в условиях антропогенной нагрузки на прибрежные местообитания. Расширение региональных альгологических исследований Черного моря приводит к обнаружению новых для науки видов и флористических находок, например, у cеверо-западного (Snigireva, Kovaleva, 2015), южного (Baytut et al., 2013; Kaleli, Akçaalan, 2021; Dirican et al., 2022) и юго-восточного побережья Черного моря (Zidarova et al., 2022). Вместе с тем, накопление обширных, но разрозненных данных, обуславливает важность создания единого списка видов и их ревизии, что необходимо для оценки разнообразия донных Bacillariophyta. Работа сфокусирована на новых находках диатомовых черноморской фитали сублиторали и анализе статуса встречаемости редких видов с помощью индекса TaxDI (Warwick, Clarke, 1998, 2001).
Материалы и методы Бентосные Bacillariophyta исследованы в период с 1984 по 2018 гг. на 17 полигонах вдоль Крыма (акватории зал. Каркинитский, пос. Марьино, р. Бельбек и референтная ст. R3, б. Карантинная, Севастопольская, Артиллерийская, р. Чёрная, б. Омега, Голубая, м. Фиолент, б. Балаклавская и референтная ст. R6, б. Ласпи, м. Сарыч, пос. Новый Свет, б. Лисья; Карадагский Природный заповедник, б. Двуякорная), на трех полигонах у российского побережья Кавказа (г. Анапа, г. Новороссийск, г. Туапсе) и одном – в акватории Филлофорного поля Зернова, на различных типах субстрата, в диапазоне глубины 0,5–75 м. Описание районов исследований, методик сбора, обработки, идентификации видов и анализа данных приведено в работах (Неврова, 2015; Неврова и др., 2015; Nevrova, Petrov, 2019 a, b).
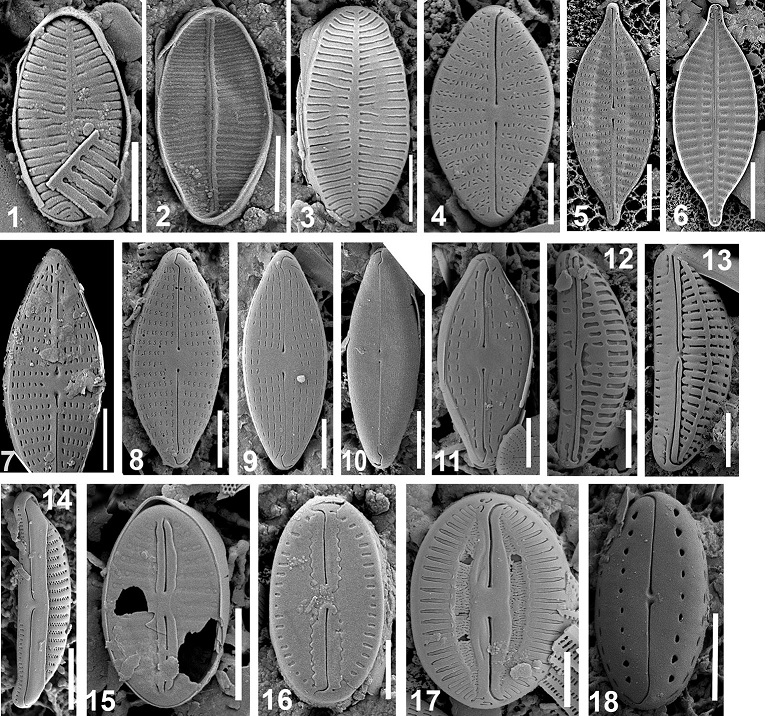
Результаты и обсуждение В результате ревизии и объединения литературных и собственных данных по пяти регионам Черного моря (побережье Болгарии, Румынии, Северо-западной части Черного моря (СЗЧМ), Крыма и Северного Кавказа) создана база данных по бентосным Bacillariophyta, насчитывающая 1100 видов и внутривидовых таксонов (ввт), принадлежащих к 953 видам, 149 родам, 61 семейству, 31 порядку и 3 классам Bacillariophyta (Неврова, 2015). При исследованиях структуры створок диатомовых под световым (СМ) и сканирующим электронным (СЭМ) микроскопами выявлены флористические находки. Описаны в соавторстве 7 новых для науки видов и предложены 7 новых таксономических комбинаций: Navicula parapontica Witkowski, Kulikovskiy, Nevrova et Lange-Bert., N. pontica (Mereschk.) Witkowski, Kulikovskiy, Nevrova et Lange-Bert. (Witkowski et al., 2010), N. petrovii Nevrova, Witkowski, Kociolek et Lange-Bert. (Witkowski et al., 2014), Lyrella abruptapontica Nevrova, Witkowski, Kulikovskiy et Lange-Bert.; L. pontieuxini Nevrova, Witkowski, Kulikovskiy et Lange-Bert., L. ruppelii Nevrova, Witkowski, Kulikovskiy et Lange-Bert., L. karayevae Nevrova, Witkowski, Kulikovskiy et Lange-Bert., L. pseudolyra Nevrova, Witkowski, Kulikovskiy et Lange-Bert., L. dilatata (A.W.F. Schmidt) Nevrova, Witkowski, Kulikovskiy et Lange-Bert., L. aestimata (Hust.) Nevrova, Witkowski, Kulikovskiy et Lange-Bert., L. rudiformis (Hust.) Nevrova, Witkowski, Kulikovskiy et Lange-Bert., L. granulata (Grunow) Nevrova, Witkowski, Kulikovskiy et Lange-Bert., L. rattrayi (Pant.) Nevrova, Witkowski, Kulilovskiy et Lange-Bert., L. bacillifera (Pant.) Nevrova, Witkowski, Kulilovskiy et Lange-Bert. (Nevrova et al., 2013). Обнаружены 8 новых для Черного моря родов: Amicula (Witkowski) Witkowski, Astartiella Witkowski, Lange-Bert. et Metzeltin, Chamaepinnularia Lange-Bert. et Krammer, Cocconeiopsis Witkowski, Lange-Bert. et Metzeltin, Eolimna Lange-Bert. et W. Schiller, Lunella P.J.M. Snoeijs, Rhoicosigma Grunow, Trachysphenia P. Petit (Неврова, 2015). Всего отмечены свыше 280 новых для флоры видов. Нам не удалось идентифицировать несколько таксонов до видового уровня. Однако эти виды включены в общий список, поскольку они морфологически отличаются от известных и задокументированы микрофотографиями. Мы воздерживаемся от описания новых видов до тех пор, пока не накоплен материал из различных популяций и не проведено детальное его изучение. Значительное количество новых для флоры видов объясняется следующими причинами. Разнообразные биотопические условия побережья Крыма (песчаный грунт, скалы, валуны, покрытые макрофитами, илистые и глинистые субстраты) представляют множество микрониш для успешного выживания видов, занесенных балластными водами либо в составе обрастаний судов из различных регионов Мирового океана. Следует также принимать во внимание интенсивный процесс медитерранизации, вносящий существенный вклад в пополнение флоры и фауны Черного моря. Предположено, что небольшую часть черноморской диатомовой флоры представляют реликты Понто-Каспийской либо Карангатской флоры, выжившие после резких изменений солевого режима Черного моря в четвертичном периоде, более значительную – успешно акклиматизировавшиеся пресноводные виды, либо виды-интродуценты из средиземноморского бассейна, и небольшую, но постоянно прирастающую группу, – инвазивные виды, недавно вселившиеся в Черное море и адаптирующиеся к иным экологическим условиям местообитания. Среди находок вполне могут быть и аборигенные формы, не выявленные ранее в Черном море по причине редкой встречаемости либо малого размера клеток, а также слабой изученности бентосных Bacillariophyta. Находки включают разноразмерные виды, которые можно условно разделить на группу мелкоклеточных (длина створки 5–15 мкм) (Lange-Bertalot et al., 2003) и группу крупноклеточных (длина створки более 15 мкм) видов. Наноклеточный вид (nano-sized diatom, длина створки менее 5 мкм) (Leblanc et al., 2018) нами обнаружен однажды, но нечеткость микрофотографии не позволила идентифицировать его даже до родового уровня. Некоторые из находок известны только из типовых местообитаний, другие являются космополитами. К первой группе относятся: Achnanthidium flexuistriatum Riaux-Gob. et al. (рис. 1: 1–3) и A. glyphos Riaux-Gob. et al. (рис. 1: 4), отмеченные в Индийском океане (Riaux-Gobin et al., 2010, 2011); Fogedia giffeniana (Foged) Witkowski et al. (рис. 1: 5, 6), отмеченная в Аденском заливе, и F. heterovalvata (Simonsen) Witkowski et al. (рис. 1: 7), отмеченная в Балтийском море и на Карибских островах (Witkowski et al., 1997); Navicula aleksandrae Lange-Bert. et al. (рис. 1: 8), N. germanopolonica Lange-Bert. et al. (рис. 1: 9), N. bozenae Lange-Bert. et al. (рис. 1: 10), и N. viminoides var. cosmomarina Lange-Bert. et al. (рис. 1: 11), обнаруженные в Гданьском заливе (Lange-Bertalot et al., 2003); Amphora exilitata Giffen (рис. 1: 12) и A. helenensis Giffen (рис. 1: 13), обнаруженные у берегов Южной Африки (Witkowski et al., 2000); Fallacia aequorea (Hust.) D.G. Mann (рис. 1: 15), отмеченная у атлантического побережья Америки (Witkowski et al., 2000) и др. К космополитам относятся: Halamphora tenerrima (Aleem et Hust.) Levkov (рис. 1: 14), F. florinae (Møller) Witkowski (рис. 1: 16), F. oculiformis (Hust.) D.G. Mann (рис. 1: 17), Biremis lucens (Hust.) Sabbe et al. (рис. 1: 18) и многие другие находки.
Рис. 1. Представители новых для Черного моря видов диатомовых: Fig. 1. Newly-found species for the Black Sea’ diatom flora.
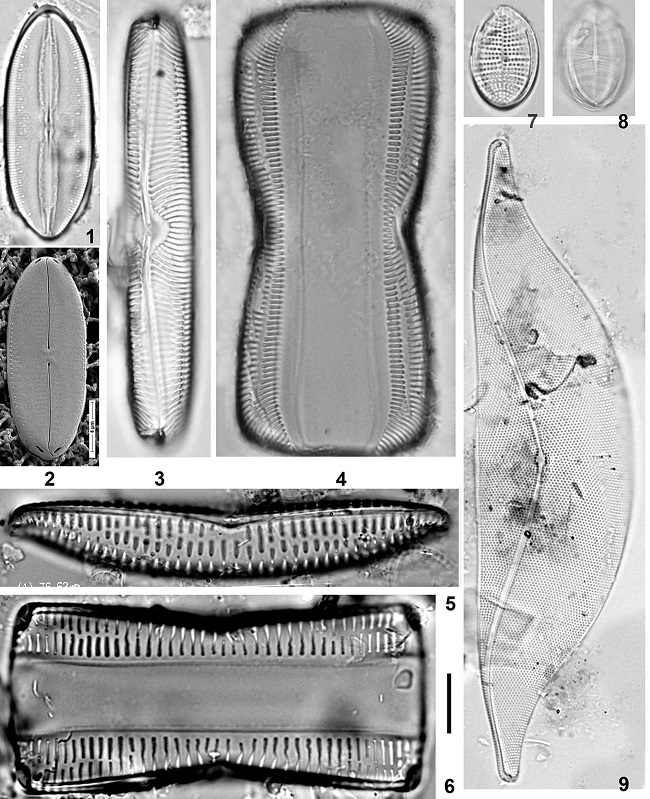
Среди новых для флоры Черного моря крупноклеточных видов упомянем Amphora decussata Grunow, Diploneis coffaeiformis (A.W.F. Schmidt) Cleve, D. stroemi Hust., Hantzschia marina (Donkin) Grunow, Mastogloia cuneata (Meister) Simonsen, Navicula arenaria Donkin, N. besarensis Giffen, N. biskanterae Hust., Navicula cf. fauta Hust., N. flagellifera Hust., N. hamiltonii Witkowski, Lange-Bert. et Metzeltin, N. johanrossii Giffen, N. northumbrica Donkin, Navicula cf. lusoria Giffen, Navicula cf. mahoodii Witkowski et Witon, Navicula cf. opima (Grunow) Grunow, Oestrupia powellii (F.W. Lewis) Heiden, Psammodictyon roridum (Giffen) D.G. Mann, P. rudum (Cholnoky) D.G. Mann и др. (Неврова, 2015). Вполне вероятно, что некоторые из вышеперечисленных мелко- либо крупноклеточных видов являются аборигенными формами, незарегистрированными ранее в Черном море вследствие недостаточной изученности бентосных диатомовых. Но вывод о том, являются ли флористические находки Bacillariophyta автохтонными либо инвазивными формами, можно сделать только после анализа филогенетических связей, присущих популяциям с характерными генотипами. Выявлен ряд видов, которые в течение ХХ в. не находили не только в Черном море, но и в Мировом океане, и потому считали вымершими. Обнаружение в геологической летописи или в актуальных условиях подобных таксонов демонстрирует т.н. «эффект Лазаря», и обусловлено оно недостаточной изученностью современной биоты либо палеонтологической истории. Изучена морфология клеток следующих «воскресших» видов: Navicula glabriuscula var. elipsoidales Proshk.-Lavr., Pinnularia trevelyana (Donkin) Rabenh., Cocconeis britannica Naegeli, Toxonidea insignis Donkin и Navicula scabriuscula (Cleve et Grove) Mereschk., описанный как новый вид N. petrovii Nevrova, Witkowski, Kociolek et Lange-Bert. (рис. 2: 1–9).
Рис. 2. Виды, не регистрируемые в течение ХХ в. в Черном море: Fig. 2. Species not registered during the XX century in the Black Sea:
Все обнаруженные в Черном море диатомовые бентоса (1100 видов и ввт) разделены на пять групп (по частоте их упоминания в литературе). Группу I образуют 120 видов, отмеченных в каждом из пяти регионов (встречаемость 100%) и стабильно присутствующих в составе региональной флоры. Группы II (103 вида, встречаемость 80%), III (129 видов, встречаемость 60%) и IV (231 вид, встречаемость 40%) сформированы из видов, зарегистрированных, соответственно, в четырех, трех, двух регионах. Наиболее многочисленна группа V (517 видов, упомянутых однократно лишь в одном из пяти регионов). Она включает виды единичные либо обильно развивающиеся в отдельных биотопах одного из пяти регионов, но нигде в фитали Черного моря более не встреченные. Таким образом, около 50% черноморской флоры бентосных Bacillariophyta составляют виды, известные по единичным находкам, причем основная часть этой группы – виды редкие, либо уникумы, либо вселенцы. Заключение о приуроченности к отдельным местообитаниям видов группы V может быть сделано только при расширении географии исследований всего Черного моря. Структура иерархического древа Bacillariophyta состоит из ветвей с тремя типами видовой насыщенности: моновидовая ветвь содержит только один вид, принадлежащий к одному роду, семейству и порядку, олиговидовые – два, поливидовые – три и более вида (Неврова и др., 2015). Филогенетика видов, принадлежащих к поливидовым таксонам, близка, поэтому исчезновение одного или даже нескольких таких видов не приведет к элиминации таксономической ветви на уровне рода, семейства и порядка и, в целом, мало скажется на структуре иерархического древа таксоцена. Такие виды характеризуются рангом низкой таксономической исключительности. Среди единично встреченных и редких видов выделена группа из 33 видов, принадлежащих к моно- и олиговидовым таксонам, которым присвоен ранг высокой таксономической исключительности, поскольку при их исчезновении из региональной флоры исчезнет целая филогенетическая ветвь. В классе Coscinodiscophyceae отмечен 21 такой вид, в классе Fragilariophyceae – 10, в классе Bacillariophyceae – 2 (Неврова и др., 2015). Отметим, что ранг исключительности оценен по показателю встречаемости в разных регионах Черного моря и по степени разветвленности таксономической ветви данного вида (Warwick, Clarke, 1998, 2001). Особо выделены 11 регион-специфичных видов, принадлежащих к моно- и олиговидовым ветвям, замыкающимся на одном роде, семействе, порядке, и встреченных только в одном из пяти рассмотренных регионов. Им присвоен ранг наивысшей таксономической исключительности. У берегов Крыма отмечено 6 таких видов (Neidium binodis (Ehrenb.) Hust., Amicula specululum (Witkowski) Witkowski, Astartiella bahusiensis (Grunow) Witkowski, Lange-Bert. et Metzeltin, A. producta Witkowski, Lange-Bert. et Metzeltin, Astartiella sp.1DV, Pauliella taeniata (Grunow) Round et Basson), у побережья СЗЧМ – 2 вида (Brachysira aponina Kütz. и Proschkinia complanatula (Hust.) D.G. Mann), у берегов Румынии – 3 (Cavinula lacustris (W. Greg.) D.G. Mann et A. Stickle, Orthoseira roeseana (Rabenh.) O'Meara и Hannaea arcus (Ehrenb.) Patrick). Отметим, что зарегистрированные у Румынии два последних вида относятся к пресноводно-солоноватоводным, поэтому массово не развиваются в морском микрофитобентосе и на самом деле не обладают рангом наивысшей таксономической исключительности и не являются критичными для флоры черноморских Bacillariophyta. Элиминация из состава флоры региона каждого вида с наивысшим рангом приведет к исчезновению из флоры целой филогенетической ветви (включая род, семейство или порядок со специфическим геномом), что заметно изменит архитектонику иерархического древа Bacillariophyta как конкретного региона, так и Черного моря в целом. Показатели индекса TaxDI при элиминации подобного вида с наивысшим рангом могут изменяться на 10% (Warwick, Clarke, 2001). Поддержание стабильности условий обитания для таких видов приоритетно для сохранения разнообразия диатомовых при современном освоении шельфовой зоны. Изменения структуры древа могут быть оценены количественно на основе применения индекса таксономической отличительности TaxDI и его показателей – AvTD и VarTD, которые рассчитываются по присутствию/отсутствию видов и не связаны с количественными данными и усилиями пробоотбора (Warwick, Clarke, 1998, 2001). Показатели TaxDI таксоцена диатомовых зависят от соотношения числа видов на иерархических ветвях с различной видовой насыщенностью на возрастающих таксономических уровнях. Очевидно, что связь между изменением соотношения числа видов в моно-, олиго- и поливидовых ветвях и показателем AvTD будет иметь сложный характер. Случаи, когда показатели AvTD достигают наивысших значений, наряду с низкими значениями вариабельности (VarTD), могут быть обусловлены наличием большой доли моно- и олиговидовых ветвей в иерархической структуре таксоценов. Иными словами, чем больше в таксоцене встречается видов, принадлежащих к моно- и олиговидовым ветвям, тем выше среднее значение индекса AvTD и почти зеркально ниже значение VarTD, по отношению к среднеожидаемому уровню, соответствующему структуре флоры Черного моря. И наоборот, чем выше видовое богатство таксоцена, основанное на поливидовых ветвях, тем ниже среднее значение AvTD, что можно проиллюстрировать примерами для побережья Крыма у м. Фиолент и б. Двуякорная (Неврова, 2016, Nevrova, Petrov, 2019 a, b). Структура таксоцена формируется в зависимости от возрастания/редуцирования видового богатства с появлением/исчезновением новых ветвей на таксономическом древе, которые замыкаются на различных уровнях иерархии (от вида до порядка). Процессы появления/исчезновения новых ветвей на видовом уровне, замыкающихся на общий уровень рода, происходят гораздо чаще, чем возникновение/элиминация новых ветвей, агрегирующихся на уровнях семейств или порядков. Нарастание/убывание числа видов происходит, в основном, при увеличении/уменьшении числа близкородственных видов. Новые виды, образующие моновидовые ветви, замыкающиеся на более высоких уровнях иерархии (семейство, порядок), появляются в структуре таксоцена намного реже. Обратный процесс – редуцирование олиго- или поливидовых ветвей, замыкающихся на высоком узле иерархии, до моновидовых, т.е. упрощение структуры таксоцена, – чаще всего вызван воздействием техногенного загрязнения или природных стрессоров (Warwick, Clarke, 1998, 2001; Bevilacqua et al., 2011). В сильно загрязненных бухтах побережья Крыма с однородными илисто-песчаными донными отложениями структура таксоценов диатомовых схожа и описывается довольно низкими показателями видового богатства, высокой долей моно- и олиговидовых ветвей в таксономическом древе и умеренной степенью вертикальной выравненности (Неврова, 2013а, б, 2014; Nevrova, Petrov, 2019б). По сравнению со среднеожидаемым уровнем TaxDI для всего Черного моря, более низкая степень иерархической выравненности структуры таксоцена характерна для сообществ, подверженных устойчивому антропогенному загрязнению (Ellingsen et al., 2005; Petrov et al., 2010; Gottschalk, Kahlert, 2012; Stenger-Kovács et al., 2014, Vilmi et al., 2016; Masouras et al., 2021).
Заключение После объединения литературных и собственных данных составлен общий список видов бентосных Bacillariophyta Черного моря, насчитывающий 1100 видов и ввт, в число которых входят свыше 280 выявленных нами флористических находок. Предположено, что черноморская флора содержит как реликты Понто-Каспийской и Карангатской флоры, акклиматизированные пресноводные виды либо виды-интродуценты и недавно вселившиеся в Черное море инвазивные виды, так и не обнаруженные ранее аборигенные виды. Почти 50% флоры диатомовых составляют однократно встреченные единичные виды. Выявлен ряд видов, которые в течение всего ХХ столетия не находили не только в Черном море, но и в Мировом океане. Выделены значимые группы из 33 и 11 видов с соответственным рангом высокой и наивысшей таксономической исключительности. Вид, образующий отдельную моновидовую ветвь на иерархическом древе, имеет высший приоритет сохранения по сравнению с видом, филогенетически близким со многими другими. Исчезновение видов диатомовых с высокой таксономической исключительностью значительно упрощает структуру флоры. Поддержание неизменности условий обитания является первостепенной мерой для сохранения разнообразия Bacillariophyta при современном освоении шельфовой зоны.
Работа выполнена в рамках финансирования Госзадания ФИЦ ИнБЮМ им. А.О. Ковалевского РАН по теме «Закономерности формирования и антропогенная трансформация биоразнообразия и биоресурсов Азово-черноморского бассейна и других районов Мирового океана» (госрегистрация № 121030100028-0). Автор заявляет об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Список литературы
Статья поступила в редакцию 27.05.2022
Об авторе Неврова Елена Леонидовна – Elena L. Nevrova доктор биологических наук el_nevrova@mail.ru Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова 2, ФИЦ ИнБЮМ. Тел. +7 (8692)54-41-10.
ССЫЛКА: Неврова Е.Л. Диатомовые бентоса Черного моря: редкие, инвазивные, «воскресшие» виды и оценка их таксономической исключительности // Вопросы современной альгологии. 2022. № 2 (29). С. 46–56. URL: http://algology.ru/1811 DOI – https://doi.org/10.33624/2311-0147-2022-2(29)-46-56 EDN – NEDTDB
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
Benthic diatoms of the Black Sea: rare, invasive, extinct species and assessment of taxonomic exclusivity Elena L. Nevrova Kovalevsky Institute of Biology of the Southern Seas of RAS (Sevastopol, Russia) Assessment of benthic diatom taxonomic diversity under increasing anthropogenic pressure on the Black Sea shelf is necessary to preserve the genetic fund of Bacillariophyta, especially for rare and relict endangered species, as well as for controlling of invasive ones. Currently, the Black Sea benthic diatom flora includes 1100 species and intraspecific taxa, among which almost 50% are singleton species. Assumed the Black Sea flora consists from relict of the Ponto-Caspian and Karangat flora, native species, freshwater species, introducers from the Mediterranean basin, and a group of aliens acclimating to another environmental condition. 8 new genera and over 280 newly found for the Black Sea diatom flora species were noted. Also species not recorded in the World Ocean during the XX century were discovered. Groups of 33 and 11 significant for preservation species were highlighted which the ranks of high and highest taxonomic exclusivity were assigned, respectively. Species formed a mono-species branch on a hierarchical tree, i.e. belonging to the same genus, family or order, has the highest preservation priority compared to a species included in a poly-species branch and phylogenetically close to many others. Disappearance of species with high taxonomic exclusivity leads to significant changes in the structure of diatom hierarchical tree. Maintenance of intact habitat conditions for species with a high taxonomic exclusivity should be primary measure to preserve the high diversity of the Black Sea’ flora Bacillariophyta. Key words: Bacillariophyta; Crimea; benthic diatoms; biodiversity; Taxonomical distinctness index
References
Author Nevrova Elena L. ORCID – https://orcid.org/0000-0001-9963-4967 Kovalevsky Institute of Biology of the Southern Seas of RAS, Sevastopol, Russia el_nevrova@mail.ru
ARTICLE LINK: Nevrova E.L. Benthic diatoms of the Black Sea: rare, invasive, extinct species and assessment of taxonomic exclusivity. Voprosy sovremennoi algologii (Issues of modern algology). 2022. № 2 (29). P. 46–56. URL: http://algology.ru/1811 DOI – https://doi.org/10.33624/2311-0147-2022-2(29)-46-56 EDN – NEDTDB When reprinting a link to the site is required
На ГЛАВНУЮ

|
|||
|
| ||