|
|
|
|
с международным участием «Водоросли: проблемы таксономии, экологии и использование в мониторинге», посвященной памяти Веры Ивановны Есыревой (Нижний Новгород) Биохимический состав Cylindrotheca closterium (Ehrenb.) Rayman net Levin как источник биологически активных веществ при накопительном режиме культивирования
Железнова С.Н., Геворгиз Р.Г. Svetlana N. Zheleznova, Ruslan G. Gevorgiz
УДК 582.261.1:551.464.6
В данной работе были исследованы биохимические характеристики диатомовой водоросли Cylindrotheca closterium в накопительном режиме культивирования в разных фазах роста. По нашим данным в экспоненциальной фазе роста биомасса C. closterium характеризуется минимальным содержанием липидов – 3% от сухой биомассы и максимальным содержанием углеводов – 23% от сухой массы. При переходе культуры C. closterium в стационарную фазу роста наблюдается достаточно высокое накопление суммарных липидов – до 28% сухой массы, при этом содержание углеводов снижается до 7%. В конце стационарной фазы (21-ые сутки культивирования) содержание жирных кислот составляет 50% от общих липидов или 12,5% от сухой массы. Была зафиксирована определенная зависимость между концентрациями фукоксантина, суммарными липидами и полиненасыщенными жирными кислотами (ПНЖК) в биомассе диатомовой водоросли C. сlosterium. Во время активного роста в экспоненциальной фазе концентрация фукоксантина составляла 0,5–1 мг.г-1 сухой массы. При переходе культуры в стационарную фазу роста концентрация фукоксантина достигла 7±0,2 мг∙г-1 сухой биомассы. В конце стационарной фазы концентрация фукоксантина достигала своего максимального значения 20 мг∙г-1 сухого веса. Ключевые слова: диатомовая водоросль Cylindrotheca closterium; липиды; белки; углеводы; ПНЖК; накопительный режим культивирования
Среди всех диатомовых водорослей особый интерес представляет бентосная диатомовая водоросль Cylindrotheca сlosterium, в составе ее фотосинтетического аппарата содержание фукоксантина достигает до 78% общего количества каротиноидов (Peng et al., 2011), что составляет 2,6% сухой массы (Wang et al., 2018), а содержание ПНЖК достигает 5–6% от сухой массы (Pereira et al., 2012; Li et al., 2014). Данная водоросль отличается от других бентосных диатомей высокой продуктивностью и высокой удельной скоростью роста (Железнова, 2019), а также довольно высокими скоростями синтеза фукоксантина и ПНЖК. Бентосная диатомовая водоросль C. сlosterium содержит большое количество кремния (3%), за счет чего C. сlosterium легко оседает на дно при отсутствии перемешивания, что позволяет сконцентрировать суспензию в 20 и более раз в течение 1–2 часов без затрат энергии, делая данный исследуемый объект удобным при культивировании в промышленных масштабах (Геворгиз и др., 2016). На практике при получении биомассы диатомовых водорослей и ценных веществ на их основе наиболее распространенным является метод накопительного культивирования (Serrazanetti et al., 2006; Suman et al., 2012; Wang et al., 2015, 2018). Кроме того, исследование продукционных и биохимических характеристик C. сlosterium в накопительном режиме культивирования является необходимым для организации проточного культивирования. Цель данной работы: исследовать биохимические характеристики диатомовой водоросли Cylindrotheca closterium (Ehrenb.) Reimann et Lewin в накопительной культуре.
Материалы и методы В работе использовали культуру диатомовой водоросли Cylindrotheca closterium (Ehrenb.) Reimann et Lewin из коллекции культур ИнБЮМ РАН. Культуру выращивали на питательной среде RS (Железнова и др., 2015), при расчете биогенных элементов на 3 грамма сухой массы водоросли (концентрации всех биогенных элементов в питательной среде RS увеличены в 3 раза), при постоянной температуре суспензии 20±1○С, в режиме накопительного культивирования в фотобиореакторах плоскопараллельного типа с рабочим объемом 2 л, слоем 5 см, при круглосуточном освещении люминесцентными лампами CE-PIL-1-LF 46W/54-765. Средняя облученность рабочей поверхности фотобиореактора составляла 150 мкмоль квантов·м–2·с–1 (33 Вт·м–2).. В процессе выращивания культуру барботировали воздухом (1,2 л воздуха на 1 л культуры в мин.) посредством компрессорной установки. Плотность культуры в начале накопительного культивирования составляла 0,1–0,2 г сухого вещества на 1 л. Параллельно при тех же условиях культуру выращивали в промышленной газовихревой системе культивирования. Рабочий объем суспензии в газовихревом фотобиореакторе составлял 580 л, рабочий слой – 0,08 м, освещаемая поверхность – 7,3 кв.м. В качестве источника освещения использовались лампы ДРЛ-700, которые давали среднюю освещенность на поверхности культуры 7,1 клк (≈30 Вт·кв.м-1). Эксперименты проводили при оптимальной рН=8–9 (Геворгиз и др., 2016). На протяжении всего эксперимента культура C. сlosterium непрерывно перемешивалась за счет создания вихревых потоков воздуха посредством вращения активатора с частотой 20 Гц (1200 об·мин-1). Затраты энергии на перемешивание составляли примерно 0,06 Вт·л-1 суспензии (Геворгиз и др. 2016). Плотность культуры определяли двумя методами: 1) методом йодатной окисляемости (Геворгиз и др., 2015) и 2) прямым взвешиванием сырой массы C. сlosterium в полипропиленовых пробирках на аналитических весах с погрешностью 0,1 мг после осаждения клеток центрифугированием (1600 g в течение 2 мин). Для пересчета полученных данных на сухую массу использовали коэффициент связи между сухой и сырой массой (k=0,1). Массовую долю белка в биомассе водорослей определяли по методу Лоури в модификации (Геворгиз, 2017) с использованием человеческого альбумина (MERCK) в качестве стандарта для построения калибровочного графика. Для определения доли белка отбирали аликвоту объемом 1–2 мл, при этом навеска сырой биомассы не превышала 0,1 г. При необходимости суспензию разбавляли морской водой. Содержание общих липидов в биомассе определяли колориметрическим методом с фосфованилиновым реактивом (Руководство..., 2004). Для определения содержания липидов из биореактора отбирали аликвоту объемом 1–2 мл; при этом навеска сырой биомассы не превышала 0,2–0,3 г. Липиды из навески сырой биомассы C. сlosterium экстрагировали смесью Фолча. Экстракцию проводили многократно до полного обесцвечивания биомассы. Углеводы в биомассе C. сlosterium определяли по методу Дюбуа (Dubois et al., 1956) в собственной модификации. Для определения содержания углеводов из биореактора отбирали аликвоту объемом 1 мл, при необходимости разбавляли в 2–3 раза морской водой. Далее центрифугировали в течение 1–2 мин при 3000 об·мин-1 и надосадочную жидкость удаляли; при этом навеска не должна превышать 0,1 г сырой массы. Содержание фукоксантина определяли методом тонкослойной хроматографии со стандартом кристаллического Фк (Рябушко и др., 2017). Жирнокислотный состав суммарных липидов культуры C. closterium анализировали методом газовой хромато-масс-спектрометрии (Suman et al., 2012). Для получения метиловых эфиров жирных кислот (МЭЖК) из биомассы микроводоросли C. closterium использовали методику (Kates, 1972). Определяли метиловые эфиры жирных кислот (МЭЖК) на газохроматографическом комплексе «Кристалл 5000.2» с пламенно-ионизационным детектором (ПИД). Разделение проводили на капиллярной колонке BPX5 фирмы «SGE Analytical Science» длиной 60 м, с внутренним диаметром 0,25 мм и с толщиной неподвижной фазы 0,25 мкм в НОЦКП «Спектрометрия и хроматография» ФГБУН ИМБИ РАН. Газохроматографическое разделение МЭЖК проводили в температурном интервале от 40°С до 280°С в режиме программирования температуры: 1) 1 мин при 40°С; 2) подъем до 220°С со скоростью 10°C/мин (6 мин); 3) подъем до 280°С со скоростью 10°С/мин (10 мин); 4) 20 мин при 280°С, общее время анализа – 45 мин. Газ–носитель – гелий, скорость потока – 1,5 мл·мин-1, ввод пробы – 1 мкл пробы без деления потока, температура испарителя – 250°С. Диапазон сканирования масс составил 50–450 m/z. Качественный анализ МЭЖК проведен путем анализа хроматограмм с использованием стандартного образца смеси МЭЖК (SUPELKO 37 component FAME mix. CRM47885). Расчет содержания эфиров жирных кислот проводился по методу процентной нормализации по площадям пиков (Kates, 1972).
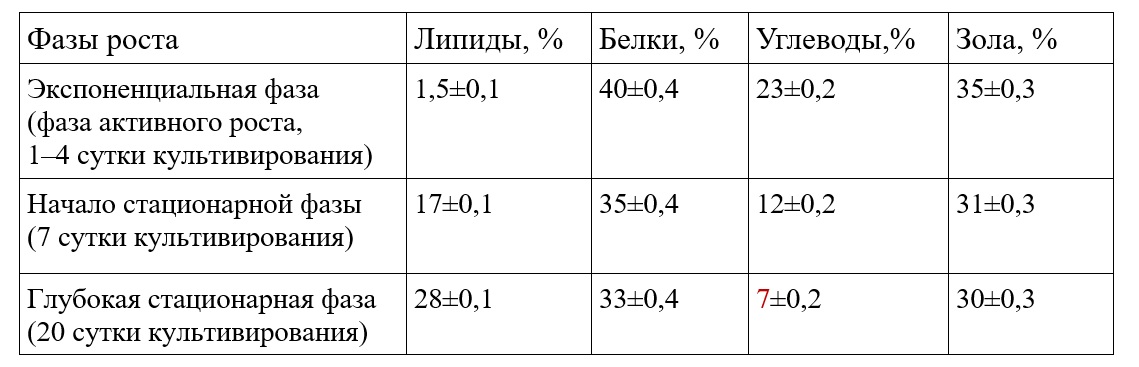
Результаты и обсуждение При накопительном культивировании концентрация массовой доли суммарных липидов и углеводов в биомассе C. closterium изменяется в широких пределах в зависимости от фазы роста. По нашим данным в экспоненциальной фазе роста биомасса C. closterium характеризуется минимальным содержанием липидов – 3% от сухой массы и максимальным содержанием углеводов – 23% от сухой массы. При переходе культуры C. closterium в стационарную фазу роста, как у представителей диатомовых водорослей, наблюдается достаточно высокое накопление суммарных липидов – до 28% сухой массы, при этом содержание углеводов снижается до 7% (табл. 1). Высокая концентрация липидов и снижение содержания углеводов в стационарной фазе роста обусловлена снижением облученности на единицу биомассы, а также лимитированием биогенными элементами (Li et al., 2014). Таблица 1. Биохимический состав диатомовой водоросли C. closterium при накопительном культивировании Table 1. The biochemical composition of the diatom C. closterium during cumulative cultivation
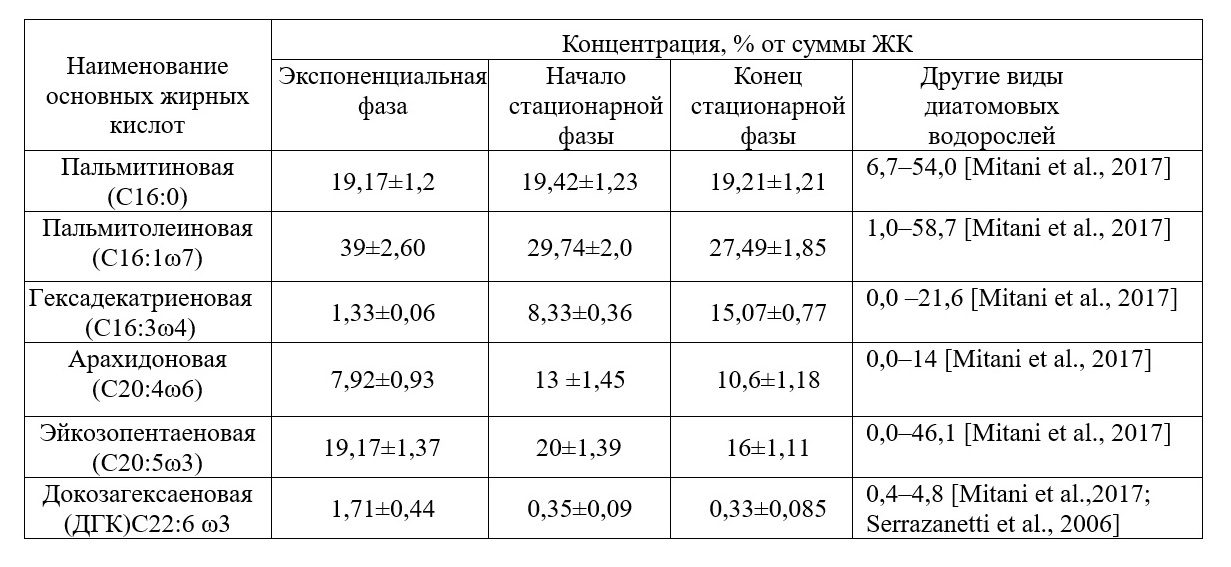
Необходимо отметить, что содержание массовой доли суммарных белков у вида C. closterium в зависимости от фазы роста изменяется незначительно – от 33% до 40% сухой массы. Поэтому C. closterium используют в аквакультуре (Brown et al., 1995). Культура C. closterium характеризуется средними для бентосных диатомей показателями содержания золы – 30–35% от абсолютно сухого веса в различных фазах роста (табл. 1). Следовательно, исследуемый штамм C. closterium по сравнению с другими видами микроводорослей имеет достаточно небольшую калорийность – 342 ккал на 100 г сухой биомассы, так как на органическое вещество приходится 65–70% сухой массы. По нашим данным, доля жирных кислот (ЖК) от общего содержания липидов в пересчете на сухую биомассу возрастает на протяжении всей стационарной фазы роста. В условиях экспоненциального роста на четвертые сутки эксперимента доля ЖК составляет 41% от общих липидов или 1,7% от сухой массы, в начале стационарной фазы роста (7 сутки культивирования) доля ЖК достигает 42% от общих липидов или 7,14% от сухой массы и в конце стационарной фазы (21 сутки культивирования) содержание жирных кислот составляет 50% от общих липидов или 12,5% от сухой массы. Также по нашим данным для штамма C. closterium характерно преобладание полярных липидов в стационарной фазе роста, на долю ПНЖК может приходиться 50% от суммы жирных кислот. Поэтому диатомовая водоросль C. сlosterium может служить перспективным и быстро возобновляемым источником незаменимых полиненасыщенных жирных кислот (ПНЖК) для человека и имеет ряд преимуществ по сравнению с другими источниками ПНЖК (морской рыбой и другими морскими гидробионтами), которые в последнее время в полной мере не обеспечивают всевозрастающую потребность населения в ПНЖК. Из литературы известно, что основными преобладающими кислотами для диатомовых водорослей, и для C. closterium в частности, являются: пальмитиновая (20% от суммы ЖК), пальмитолеиновая кислота (30–40% от суммы ЖК), эйкозопентаеновая (10–25% от ЖК) и арахидоновая кислоты (8–10% от ЖК). В нашей работе рассматривается содержание только данных кислот. Из табл. 2 видно, что максимальное содержание пальмитолеиновой кислоты наблюдается в экспоненциальной фазе роста (39% от суммы ЖК), при достижении культурой стационарной фазы концентрация данной кислоты снижается и составляет 29,7% от ЖК. Это можно объяснить тем, что данная кислота находится в начале цепочки биосинтеза длинноцепочечных жирных кислот (Li et al., 2014). Ценность пальмитолеиновой кислоты заключается в проявлениии высокой биологическую активность относительно грамположительных бактерий.
Таблица 2. Содержание основных жирных кислот диатомовой водоросли C. closterium Table 2. The content of basic fatty acids of diatom C. closterium in different phases of growth
По нашим данным диатомовая водоросль C. closterium содержит высокие концентрации эйкозапентаеновой (16–20%) и арахидоновой (7–13%) кислот во всех фазах роста, что имеет большое прикладное значение, т.к. эйкозапентаеновая кислота обладает профилактическим действием против сердечно-сосудистых заболеваний (Гладышев, 2012; Manerba et al., 2010), а арахидоновая кислота служит предшественником гормоноподобных веществ, известных как эйкозаноиды (простагландины, тромбоксаны, лейкотриены и др.) (Abdo et al., 2015). При этом содержание эйкозапентаеновой кислоты возрастает в экспоненциальной фазе роста и достигает максимума в стационарной фазе роста (20% от суммы ЖК или 11,89 мг·г-1сухой массы). Максимальная концентрация арахидоновой кислоты (13% от суммы ЖК или 9,5 мг·г-1сухой массы) зафиксирована в конце стационарной фазы роста. Ранее авторами наблюдалась определенная зависимость между концентрацией фукоксантина, суммарными липидами и ПНЖК в биомассе диатомовой водоросли Cylindrotheca closterium (Железнова и др., 2018). Во время активного роста в экспоненциальной фазе концентрация фукоксантина составляла 0,5–1 мг·г-1 сухой массы. При переходе культуры в стационарную фазу роста концентрация фукоксантина достигла 7±0,2 мг·г-1 сухой биомассы, в основном за счет увеличения биомассы культуры, а также за счет синтеза фукоксантина в клетках во время фазы замедления роста. В течение всей стационарной фазы роста зафиксировано постоянное увеличение содержания фукоксантина в биомассе C. closterium, и в конце стационарной фазы концентрация фукоксантина достигала своего максимального значения 20 мг∙г-1 сухого веса. Активные процессы биосинтеза фукоксантина в стационарной фазе C. closterium обусловлены низкими значениями концентраций питательных веществ в среде в стационарной фазе роста, а также низкой освещенностью, поскольку при недостатке освещенности более востребована светособирающая функция и синтез ксантофиллов замещается синтезом фукоксантина. В газовихревой системе культивирования за 4 суток культура выходит в стационарную фазу роста и достигает своей максимальной биомассы 3 г∙л-1, при этом отмечено, что концентрация фукоксантина составляет 5 мг∙г-1 сухой массы, липидов – 6,4% от сухой массы и ПНЖК – 3% от сухой массы. Следовательно, средняя скорость биосинтеза фукоксантина и липидов в газовихревой системе составляет 1,25 мг и 16 мг в сутки соответственно.
Заключение Показана возможность получения интенсивной культуры бентосной диатомовой водоросли Cylindrotheca closterium с высоким содержанием ПНЖК и фукоксантина в промышленных масштабах. Зафиксировано преобладание ω3 полиненасыщенных жирных кислот в биомассе C. closterium. Выявлено, что только в конце стационарной фазы роста биомасса диатомовой водоросли C. closterium характеризуется максимальной концентраций липидов – 28% от сухой массы, максимальной концентрацией жирных кислот и максимальным содержанием фукоксантина – 20 мг∙г-1 сухого веса.
Работа выполнена в рамках госзадания ФИЦ ИнБЮМ по теме «Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса» (№ гос. регистрации АААА-А18-118021350003-6). Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данном сообщении.
Список литературы
Статья поступила в редакцию 30.06.2020
Об авторах Железнова Светлана Николаевна – Svetlana N. Zheleznova младший научный сотрудник, ФИЦ «Институт биологии южных морей имени А.О.Ковалевского РАН» - ФИЦ ИнБЮМ РАН, Севастополь, Россия (Kovalevsky Institute of Biology of the Southern Seas of RAS, Sevastopol, Russia), Отдел биотехнологий и фиторесурсов zheleznovasveta@yandex.ru Геворгиз Руслан Георгиевич – Ruslan G. Gevorgiz кандидат биологических наук r.gevorgiz@yandex.ru Корреспондентский адрес: Россия, 299011, г. Севастополь, пр. Нахимова, 2, ФИЦ ИнБЮМ РАН; тел. +7 (869) 255-07-95.
ССЫЛКА: Железнова С.Н., Геворгиз Р.Г. Биохимический состав Cylindrotheca closterium (Ehrenb.) Rayman net Levin как источник биологически активных веществ при накопительном режиме культивирования. 2021. №1 (25). С. 1–9. URL: http://algology.ru/1683 DOI – https://doi.org/10.33624//2311-0147-2021-1(25)-1-9
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
The biochemical composition of Cylindrotheca closterium (Ehrenb.) Rayman net Levin, as a source of biologically active substances in cumulative cultivation Svetlana N. Zheleznova, Ruslan G. Gevorgiz Kovalevsky Institute of Biology of the Southern Seas of RAS (Sevastopol, Russia) In this work, we studied the biochemical characteristics of the diatom Cylindrotheca closterium in the cumulative mode of cultivation in different phases of growth. According to our data, in the exponential growth phase, C. closterium biomass is characterized by a minimum lipid content of 3% of dry biomass and a maximum carbohydrates content of 23% of dry weight. During the transition of C. closterium culture to the stationary growth phase, as in the case of a representative of diatoms, a rather high accumulation of total lipids is observed – to 28% dry weight, while the carbohydrates content decreases to 7%. At the end of the stationary phase (21st day of cultivation), the content of fatty acids is 50% of total lipids or 12.5% of dry weight. A certain relationship between the concentrations of fucoxanthin, total lipids and polyunsaturated fatty acids (PUFA) in the biomass of C. сlosterium diatom was recorded. During active growth in the exponential phase, the concentration of fucoxanthin was 0.5–1 mg∙g-1 dry weight. During the tranition of the culture to the stationary phase of growth, the concentration of fucoxanthin reached 7±0.2 mg∙g-1 dry biomass. At the end of the stationary phase, the concentration of fucoxanthin reached its maximum value of 20 mg∙g-1 dry weight. Key words: diatom Cylindrotheca closterium; lipids; proteins; carbohydrates; PUFA; cumulative cultivation mode
References
Authors Zheleznova Svetlana N. ORCID – https://orcid.org/0000-0003-1800-5902 Kovalevsky Institute of Biology of the Southern Seas of RAS, Sevastopol, Russia zheleznovasveta@yandex.ru Gevorgiz Ruslan G. ORCID – https://orcid.org/0000-0002-8017-5593 Kovalevsky Institute of Biology of the Southern Seas of RAS, Sevastopol, Russia r.gevorgiz@yandex.ru
ARTICLE LINK: Zheleznova S.N., Gevorgiz R.G. The biochemical composition of Cylindrotheca closterium (Ehrenb.) Rayman net Levin, as a source of biologically active substances in cumulative cultivation. Voprosy sovremennoi algologii (Issues of modern algology). 2021. № 1 (25). P. 1–9. URL: http://algology.ru/1683 DOI – https://doi.org/10.33624//2311-0147-2021-1(25)-1-9 When reprinting a link to the site is required
На ГЛАВНУЮ
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ
|
|||
|
| ||