|
|
|
|
с международным участием «Водоросли: проблемы таксономии, экологии и использование в мониторинге», посвященной памяти Веры Ивановны Есыревой (Нижний Новгород) Использование пластиковых элементов для увеличения контактной поверхности субстрата при культивировании прикреплённых видов водорослей
Калинина О.Ю.1, Сапожников Ф.В.2, Снигирёва А.А.3, Салимон А.И.4,5, Olga Yu. Kalinina, Philipp V. Sapozhnikov, Anastasiya A. Snigirova,
1Московский Государственный Университет имени М.В. Ломоносова,
УДК 574.586 +58.084.1+691.175.5/.8
Осуществлен ряд экспериментов с применением полос (и сети) из синтетических полимеров для увеличения контактной поверхности при культивировании прикрепленных форм микрофитов. Использовали полосы разного состава, а также с различными по микрорельефу участками поверхности, и мелкоячеистую сеть PLA с неоднородной поверхностью. Эксперименты проводили на жидких питательных средах в накопительных культурах и на твердой питательной среде – в чистой культуре. Результаты показали ряд положительных особенностей такого культивирования, основывающихся на селективном выделении отдельных видов и их небольших комбинаций из состава накопительных культур, а также на эффективном росте отдельных видов на специфических элементах микрорельефа поверхностей полимеров. Были использованы полимеры: PET, PP, LDPE, UHMWPE и PLA. Ключевые слова: эпипсаммон; микроэпилитон; микроэпифитон; культивирование; микроводоросли; пластик; неоднородная поверхность; колонизация
Выращивание микроводорослей широко изучается для производства биотоплива, химикатов, в том числе фармацевтического применения, кормов и нутрицевтиков. Культивирование микрофитов применяется и для эффективной очистки сточных вод (Mata et al., 2010; Kesaano, Sims, 2014; Pittman et al., 2011), а также для снижения выбросов CO2 (Brune et al., 2009) и аммиака (Kang et al., 2014). При культивировании эпипсаммических, эпилитных и эпифитных форм микрофитов на твердых и жидких средах необходимо принимать во внимание ограниченность поверхности субстрата, доступной для заселения этими организмами. Как правило, такие микрофиты заселяют в жидкой среде стенки сосудов для культивирования, а на твердых средах – поверхности среды и, отчасти, стенки сосудов. Для более эффективного разрастания в культуре таких видов необходимы пути увеличения контактной поверхности, на которой они могут развиваться. При этом необходимо принимать во внимание возможность проникновения света и, для жидких сред, циркуляции биогенов. Из биотехнологических исследований последнего времени известно, что реакторы для культивирования водорослевых биоплёнок являются многообещающей системой выращивания, способной экономично производить биомассу без необходимости применения дорогостоящих операций по уборке урожая (Gross et al., 2015, 2016). При этом важнейшим компонентом систем биопленки водорослей является материал, используемый для крепления. Крайне важно, что системы культивирования биоплёнок водорослей представляют собой ценную альтернативу суспензионным системам, которым ещё только предстоит стать экономически выгодными. Одно из главных преимуществ систем производства водорослевой биопленки заключается в том, что водоросли можно собрать просто путем соскабливания и таким образом избежать дорогостоящих процедур сбора урожая, используемых при сборе биомассы, выращенной на основе суспензии, – речь идёт о флокуляции и центрифугировании. В последние годы был разработан ассортимент систем культивирования биопленки водорослей с различными конфигурациями дизайна и производственными мощностями. Во всем спектре исследований, осуществлённых прежде, были рассмотрены возможности культивирования на предлагаемых субстратах (в т.ч. на синтетических полимерах) уже подготовленных культур микрофитов: как чистых, так и смешанных (Gross et al., 2015, 2016). Отличительной чертой наших экспериментов является выделение определённых видов и их комбинаций из накопительных культур, получаемых на основе живых проб из природной среды, на твёрдый субстрат – в частности, на синтетические полимеры. А также изучение характера колонизации этих субстратов разными видами микрофитов, в зависимости от типа полимера и свойств его поверхности. Начало этим экспериментам было положено, когда наши наблюдения показали, что некоторые виды диатомей из рода Nitzschia, выделяемые из накопительной культуры на агаризованную среду, способны изменять микрорельеф поверхности твердой среды и, тем самым, увеличивать контактную поверхность при интенсивном росте колониальных поселений. При существенном увеличении плотности колониального поселения происходит деформация поверхности твердой среды в виде концентрических волн или складок. Однако такой механизм самостоятельной модификации поверхности среды использовали далеко не все эпипсаммические, эпилитные или эпифитные виды. Мы решили пронаблюдать за тем, как поведут себя колониальные поселения, выделяемые на искусственную среду из накопительных проб, на различных твёрдых субстратах. В наших экспериментах по поддержанию накопительных культур микроводорослей в емкостях из разнотипного пластика (полиэтилен, полипропилен и полиэтилентерефталат) был отмечен ряд интересных деталей. В частности, на пластиковые стенки сосудов переходили только некоторые виды из числа тех, что росли на песке или ином природном субстрате, размещенном в емкости. С одной стороны, это говорит о возможном селективном влиянии пластика как самостоятельной среды обитания; с другой стороны, это дает возможности для выделения в культуру определенных видов, способных колонизировать конкретный пластик – в том числе, возможно, прямо из природной среды. Также наблюдения показали, что состав и характер поверхности пластика (наличие абразивных царапин, трещин и вмятин, а также иных элементов микрорельефа при пористой поверхности) дают дополнительные возможности для колонизации микрофитами его толщи. Все эти наблюдения послужили предпосылками для ряда экспериментов с использованием пластиковых конструкций в качестве дополнительных элементов колонизируемой поверхности.
Материалы и методы исследования Были использованы жидкостные накопительные культуры микрофитов из следующих местообитаний: городской пляж г. Мумбаи (Аравийское море, Индия), песчаная литораль г. Зеленоградск (Балтийское море, Россия), каменистый пляж п. Сукко (Черное море, Краснодарский край, Россия), песчаное побережье о. Сантьягу (Атлантический океан, Кабо-Верде), песчаные мелководья Малого Аральского моря (Казахстан), песчано-ракушечные мелководья Каспия (Казахстан) и горное озеро Карачаево-Черкесии (Россия). Для поддержания накопительных культур были использованы жидкие среды: ESAW – для морских видов (Harrison et al., 1980; Berges et al., 2001), BG-II – для пресноводных водорослей (Allen, Stanier, 1968; Rippa et al. 1979; Watanabe, 2005). Чистую культуру, выделенную с Черноморского побережья (Туапсе, Россия), растили на твердом субстрате в присутствии агаризованной среды BG-II. В емкостях с накопительными и чистыми культурами были размещены образцы пластика. При этом использовали белый пористый сверхвысокомолекулярный полиэтилен (UHMWPE, прямоугольными брусками 2×5×0,5 см), сетку из белого полилактида (PLA, толщина сетки 2 мм, с треугольной ячеей при стороне 7 мм), а также узкие ленты из пластика бытового назначения других типов: полиэтилен терефталата из бутылок (PET), полиэтилен низкого давления из пакетов (тонкий) и крышек от бутылей для кулера (толстый) (LDPE) и полипропилен из одноразовых стаканов (PP). Ленты представляли собой полоски шириной 5–7 мм и длиной 5–8 см. Отдельные участки лент (полосок) были подвергнуты абразивному воздействию с помощью мелкозернистой наждачной бумаги с целью получения заведомо более неоднородных участков поверхности. Образцы UHMWPE и PLA вывешивали в накопительных культурах на медной проволоке, и эти культуры не перемешивали. В остальных случаях культуры с образцами пластика размещали на платформе установки с имитацией искусственной волны, разработанной сотрудницей Сколтеха Ярославой Каляевой, и жидкость в емкостях перемешивалась с интервалом в 5 секунд. Ленты пластика при этом плавали в емкостях свободно. Размещение образцов пластика по культурам отображено в табл. 1. Экспозиция образцов пористого UHMWPE и PLA продолжалась 3 недели, остальные образцы экспонировали месяц. Во всех случаях освещение было постоянным и обеспечивалось с помощью светодиодных ламп LED1106 G2 2.3 W 18 mA 35 lm/W. Источники света находились на расстоянии 45 см от емкостей с культурами. Микроскопирование и фотодокументирование микрофитов – как на естественных субстратах накопительных культур, так и на прозрачных образцах пластика – проводили начиная с 7-го дня от начала экспериментов и повторяли далее через каждую следующую неделю на протяжении 2 месяцев, с помощью световых микроскопов Leica DMLS и Leica DM2500, стереомикроскопа Carl Zeiss. Обрастания на непрозрачных образцах (UHMWPE и PLA) исследовали с помощью сканирующих электронных микроскопов Hitachi TM 1000, а также Tescan LYRA и Tescan MAIA3.
Таблица 1. Применение различных полимеров в разных накопительных культурах
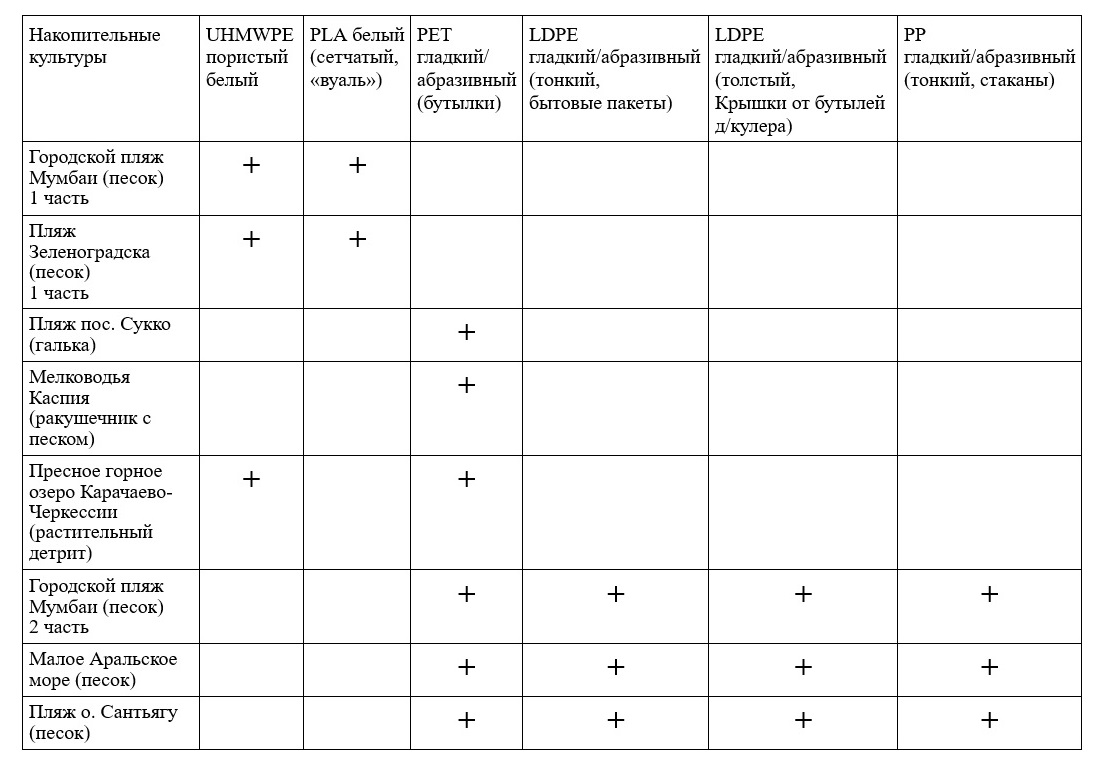
Результаты исследований Наблюдения показали, что разные виды микрофитов способны колонизировать поверхность разных типов пластика в одних и тех же накопительных культурах. Например, в культуре с литорали Балтийского моря на пористый UHMWPE перешли только два вида из двенадцати, населявших песок. В частности, это были Karayevia amoena, формировавшая обширные колониальные поселения на пластике (рис. 1, 2), а также Melosira nummuloides, встречавшаяся здесь в виде отдельных клеток или коротких колоний.
Рис. 1. Фрагмент обширного и густого колониального поселения Karayevia amoena на поверхности пористого UHMWPE. Накопительная культура из Балтийского моря.
Рис. 2. Участки колониального поселения Karayevia amoena на поверхности пористого UHMWPE.
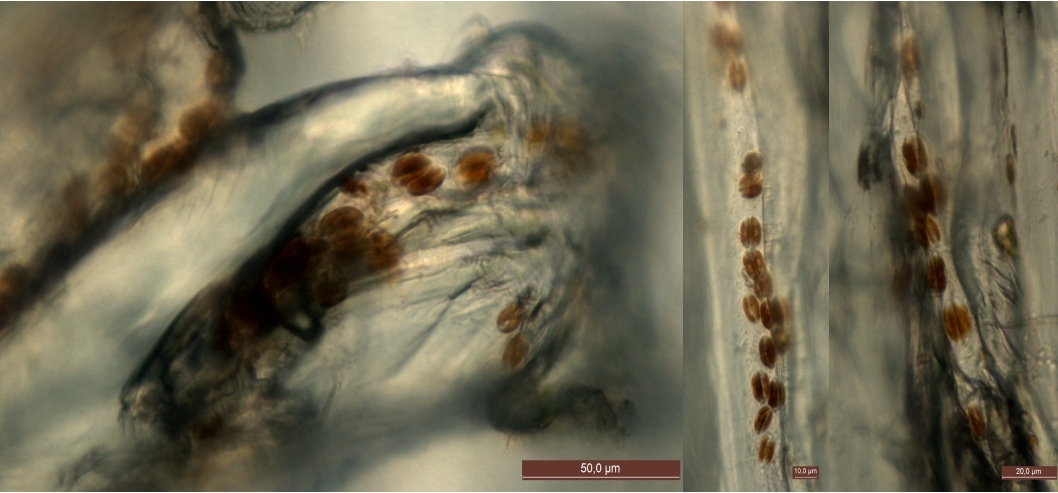
За то же время и на таком же субстрате в культуре с побережья Аравийского моря (включавшей 10 видов микрофитов) сформировались колониальные поселения Halamphora coffeaeformis и Н. cymbifera. Здесь же в некоторых местах встречались небольшие группы клеток Karayevia amoena. В свою очередь, на полилактидной сетке в культуре из Балтийского моря поселился только один вид Нyalodiscus stelliger (рис. 3), клетки которого предпочитали селиться в небольших углублениях в поверхности субстрата, прикрепляясь к нему короткими полимерными тяжами. На таком же субстрате в культуре из Аравийского моря развивался также один единственный вид, но здесь это была Halamphora cymbifera. Особенно густые колониальные поселения в виде лент, распростертых по субстрату, вид формировал в тех местах, где на субстрате были борозды (рис. 4).
Рис. 3. Клетки Нyalodiscus stelliger на поверхности PLA.
На полосках PET, размещенных в культуре из сильно эвтрофированной бухты Сукко, где жили 18 видов микрофитов, уже на следующий день от начала эксперимента был отмечен густой бурый налет, образованный Amphora helenensis, Halamphora bigibba и Oscillatoria sp. Колониальные поселения этих видов, постепенно уплотняясь, эффективно колонизировали данный субстрат на протяжении месяца, а затем, как показали эпизодические наблюдения, еще целый год.
Рис. 4. Колониальные поселения Halamphora cymbifera на поверхности складчатых волокон сетки PLA.
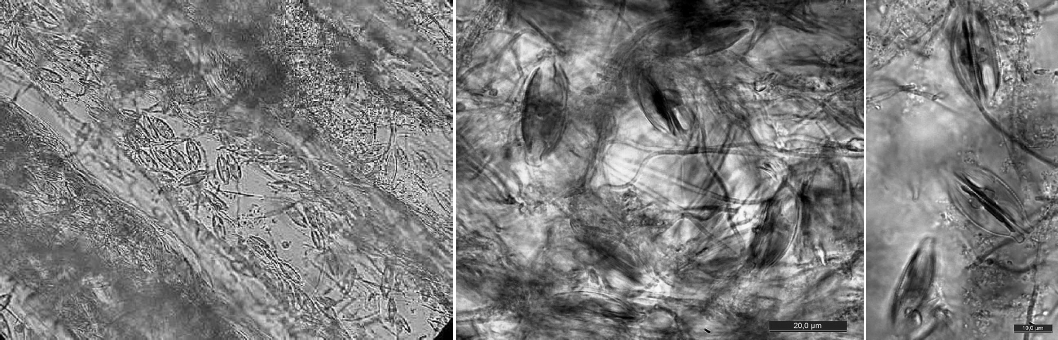
В накопительной культуре со дна Каспия, на ракушечно-песчаном субстрате, обитали свыше двадцати видов диатомей и цианопрокариот. На полоски PET здесь перешли только пять видов: Geitlerinema amphibium, Geitlerinema sp., Amphora cf. helenensis, Cocconeis neodiminuta и Karayevia clevei – последний вид образовывал распростертые колониальные поселения высокой плотности (рис. 5) площадью до нескольких кв. см. C. neodiminuta разрастался небольшими компактными группами (в несколько десятков клеток) среди практически сплошного покрова K. clevei. Клетки A. helenensis встречались поодиночке. Мощный оброст этого типа, образовавшийся на полосках к концу эксперимента, просуществовал еще более года.
Рис. 5. Колониальные поселения Karayevia clevei на поверхности полосок PET.
В культуре из пресноводного горного озера из Карачаево-Черкесии обитали 15 видов микрофитов. На поверхность PET к массовому размножению перешли только три вида диатомей: Planothidium frequentissimum, Eunotia arcus и Achnanthidium jackii (очень мелкая форма, не более 12–15 мкм в длину). Однако, на поверхность пористого UHMWPE перешли 8 видов диатомей, и 5 из них массово размножились на этом субстрате. Интересно отметить, что каждый из этих пяти видов был приурочен в своей локализации к определенным элементам микрорельефа поверхности ‑ отличался микротопологическими предпочтениями (рис. 6, 7).
Рис. 6. Развитие колониальных поселений Planothidium frequentissimum и Nitzschia frustulum
В частности, клетки P. frequentissimum предпочитали формировать разреженные колониальные поселения на «мостиках» или иных приподнимающихся элементах рельефа (рис. 6); Staurosira venter заполняла лунки, ямки и каверны компактными скоплениями цепочковидных колоний. В составе таких агрегатов было до нескольких сотен клеток. Длинные клетки Ulnaria ulna прикреплялись также на дне понижений субстрата, однако, существенно поднимаясь над его поверхностью благодаря своей длине, формировали верхний ярус оброста. Клетки Nitzschia frustulum образовывали короткие лентовидные колонии на дне углублений, а цепочки Melosira varians располагались по каналовидным углублениям между выступающими элементами поверхности (рис. 7).
Рис. 7. Развитие компактных колониальных поселений Staurosira venter,
В экспериментах с одновременным экспонированием целой линейки образцов пластика (PP, PET и LDPE) были задействованы накопительные культуры с побережья о. Сантьягу, с пляжа Мумбаи и с песчаных мелководий Малого Аральского моря. Здесь мы отмечали образование различных структур обрастания, в зависимости как от материала, так и от микрорельефа его поверхности: на гладких (ровных) и абразивных участках. В культуре с литорали о. Сантьягу обитали 8 видов микрофитов. Из них на пластик вышли 1–4 (в зависимости от субстрата и рельефа): Halamphora tenerrima, Fallacia sp., Chrysosphaera cf. marina и Geitlerinema sp. Колонизация полосок PP произошла преимущественно по абразивным участкам, где клетки H. tenerrima интенсивно размножались на дне бороздок, нанесенных наждачной бумагой (рис. 8). При этом клетки здесь, делясь, изначально захватывали пространство борозды на максимально возможную длину, располагаясь через почти равные расстояния, а затем переходили к размножению без расхождения, формируя небольшие загнутые ленты, характерные для Halamphora и Amphora в условиях культивирования. Между бороздками клеток H. tenerrima практически не было. На ровных, не подвергнутых абразии участках PP, клетки этого вида встречались изредка и по 1–2, как правило, в окружении небольшого количества мелких Fallacia sp. (длиной по 5–7 мкм). На поверхности PET, независимо от наличия абразии, сформировались биопленки на основе бактериального матрикса, включавшие в большом количестве H. tenerrima, Fallacia sp. (компактными агрегатами до нескольких десятков), Chrysosphaera cf. marina и пронизанные трихомами Geitlerinema sp.
Рис. 8. Колонизация абразивного участка поверхности полоски РР клетками Halamphora tenerrima.
В той же культуре, при росте на полосках из толстого LDPE (крышки), H. tenerrima колонизировала исключительно борозды, носившие здесь рваный характер ввиду большей мягкости материала. При этом клетки также изначально захватывали пространство борозды по ее длине, а затем переходили к делению почти без расползания, формируя компактные очаги роста. Чем глубже им удавалось забраться в щель рваной борозды, тем более интенсивно они там размножались (рис. 9). На этот субстрат вышли также трихомы Geitlerinema sp. ‑ они тоже обжили борозды, но в незначительном количестве. Колонизация поверхности тонкого LDPE (полоски из упаковочных пакетов разного цвета) произошла за месяц в незначительной степени: клетки H. tenerrima формировали здесь небольшие разрозненные группы и только на участках неглубоких деформаций. Среди них встречались клетки Ch. cf. marina. В культуре с пляжа Мумбаи на полоски пластика вышли 2 вида диатомей (Karayevia ploenensis var. gessneri и Halamphora cf. ghanensis) и цианобактерия Leptolyngbya sp. 1. При этом на полосках PP мы наблюдали развитие плотных поселений K. ploenensis var. gessneri и густое расположение трихомов Leptolyngbya sp. 1 в бороздках на абразивных участках (между бороздками попадались лишь редкие клетки и трихомы), и крайне разреженные поселения всех трех видов ‑ на участках с относительно ровной поверхностью. На образцах толстого LDPE (пробки) трихомы Leptolyngbya sp. 1 формировали густые распростертые куртинки на абразивных участках, а клетки Karayevia здесь встречались редко; на ровных участках оба вида обитали значительно реже. На полосках тонкого LDPE (пакеты) Leptolyngbya sp. 1 образовала обширные пленчатые пятна переплетающихся трихомов, а присутствие Karayevia носило характер небольших компактных поселений, укрытых под трихомами. Наконец, на PET развивались все три вида, предпочитая абразивные участки, и группы клеток диатомей росли под цианобактериями.
Рис. 9. Развитие колониальных поселений Halamphora tenerrima
В культуре из Малого Аральского моря на пластик вышли также 3 вида (из восьми, длительное время живших в песке на дне плошки): Halamphora subholsatica, Navicula sp. 1 и Leptolyngbya sp. 2 (рис. 10). При этом на всех 4 полимерных субстратах комбинация сохраняла постоянство состава, однако на PET основу оброста составляли переплетения трихомов Leptolyngbya sp. 2, на PP и толстом LDPE – H. subholsatica, поверх которой развивалась уже пленка из трихомов, а на тонком LDPE – разрозненные компактные группы клеток H. subholsatica и Navicula sp. 1, при незначительном развитии цианобактерий.
Рис. 10. Колониальные поселения Halamphora subholsatica и Leptolyngbya sp. 2 на поверхности абразивного участка полоски PP. В нижнем слое развиваются диатомеи, над ними – цианобактерии. Снимки при большом увеличении (справа) сделаны сквозь полоску PP – поселения видны с нижней стороны. Фото: Калинина О.Ю., Сапожников Ф.В.
Переход микрофитов в культуре на пластик был отмечен и на твердых средах. В чашках Петри на агаризованной среде BG-II были размещены в вертикальном положении полосы PET шириной 2 см (рис. 11, а). На среду был произведен посев чистой культуры аэрофильной (почвенной) зеленой микроводоросли Scotiellopsis cf. reticulata, выделенной из района Туапсе в 2013 г. Через 2 недели роста микрофиты успешно колонизировали не только агар, но и предложенные им поверхности неагаризованного субстрата. На полосах PET они сформировали многочисленные, густо расположенные колониальные поселения (рис. 11, б). Рост на поверхности агара был существенно более интенсивным, а поселения – крупнее. Отметим, однако, что развитие достаточно густого слоя обрастания S. cf. reticulata произошло на поверхности синтетического полимера, во влажной среде и только в присутствии питательной субстанции в качестве единственно возможного источника влаги и необходимых для роста соединений. По сути, здесь мы имеем дело с аэропоническим культивированием, оказавшимся возможным при выращивании почвенных видов микрофитов – с использованием полосок PET в качестве элементов конструкции, позволяющих многократно увеличить площадь контактной поверхности, и без дополнительных затрат питательной среды.
Рис. 11. Расположение полос PET на агаризованной питательной среде (а) и колониальные поселения Scotiellopsis cf. reticulata на поверхности неагаризованного PET (б).
Результаты этих экспериментов позволяют нам сделать ряд выводов: 1. Далеко не все виды микрофитов из числа развивающихся в накопительной культуре оказываются способны колонизировать субстраты из синтетических полимеров – таких видов, как правило, немного; 2. Поверхность разных полимеров в одной и той же культуре могут колонизировать разные виды, притом различные по абразии участки одного и того же полимера могут быть заселены не одними и теми же видами; 3. Интенсивность роста одних и тех же видов на разных по составу, абразии (и иных особенностях микрорельефа) поверхностях полимеров неодинакова; 4. При создании дополнительных поверхностей для роста некоторых аэрофильных микрофитов в присутствии агаризованной среды с применением полос PET отмечен эффект аэропонического культивирования. Все это свидетельствует в пользу возможности эффективного использования полос (лент) из синтетических полимеров (PP, PET и толстого LDPE, а в ряде случаев – пористого UHMWPE и сетчатого PLA) в качестве дополнительного субстрата, существенно увеличивающего площадь контактной поверхности при культивировании эпипсаммических, эпифитных и эпилитных форм микрофитов. При этом само присутствие таких полимерных элементов оказывает селективное действие на комбинации видов при их заселении. Это способствует выделению видов из накопительных культур. Однако, в большинстве случаев, заселение полимеров происходит комбинациями из 2–3 (5) видов.
Работы были выполнены при финансовой поддержке гранта РФФИ № 19-55-80004 и в рамках Госзадания 121051400082-4 «Географические основы устойчивого развития энергетических систем с использованием возобновляемых источников энергии». Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данном сообщении.
Список литературы
Статья поступила в редакцию 30.06.2020
Об авторах Калинина Ольга Юрьевна – Olga Yu. Kalinina младший научный сотрудник, Московский государственный университет им. М.В.Ломоносова, Москва, Россия (Lomonosov Moscow State University, Moscow, Russia), географический ф-т, НИЛ ВИЭ bio-energymsu@mail.ru Сапожников Филипп Вячеславович – Philipp V. Sapozhnikov кандидат биологических наук fil_aralsky@mail.ru Снигирёва Анастасия Александровна – Anastasiya A. Snigirova кандидат биологических наук snigireva.a@gmail.com Салимон Алексей Игоревич – Alexey I. Salimon кандидат физико-математических наук a.salimon@skoltech.ru Каляева Ярослава Владимировна – Yaroslava V. Kaliaeva технолог, Сколковский Институт Науки и Технологий, Москва, Россия (Skolkovo Institute of Science and Technology, Moscow, Russia), ЦКП «Фаблаб и Мастерская» J.kalyaeva@gmail.com Корреспондентский адрес: Россия, 117997, Москва, Нахимовский проспект, д.36, ИОРАН. Тел. (499) 124-79-96.
ССЫЛКА: Калинина О.Ю., Сапожников Ф.В., Снигирёва А.А., Салимон А.И., Каляева Я.В. Использование пластиковых элементов для увеличения контактной поверхности субстрата при культивировании прикрепленных видов водорослей // Вопросы современной альгологии. 2021. №1 (25). С. 110-123. URL: http://algology.ru/1628 DOI – https://doi.org/10.33624/2311-0147-2021-1(25)-110-123
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
The use of plastic details to increase the contact surface of the substrate during the cultivation of attached species of algae Olga Yu. Kalinina1, Philipp V. Sapozhnikov2, Anastasiya A. Snigirova3, Alexey I. Salimon4,5, Yaroslava V. Kaliaeva5 1Lomonosov Moscow State University (Moscow, Russia)
A series of experiments was carried out using strips (and nets) of synthetic polymers to increase the contact surface during the cultivation of attached forms of microphytes. We used bands of different composition, as well as with different microrelief surface areas, and a fine-mesh PLA network with an inhomogeneous surface. The experiments were performed on liquid nutrient media in accumulative cultures, and on solid nutrient medium in pure culture. The results showed a number of positive features of such cultivation, based on the selective isolation of individual species and their small combinations from the composition of accumulative cultures, as well as on the effective growth of individual species on specific elements of the microrelief of polymer surfaces. The polymers used were: PET, PP, LDPE, UHMWPE and PLA. Key words: epipsammon; microepilithon; microepiphyton; cultivation; microalgae; plastic; heterogeneous surface; colonisation
References
Authors Kalinina Olga Yu. ORCID – https://orcid.org/0000-0001-9446-9149 Lomonosov Moscow State University, Moscow, Russia bio-energymsu@mail.ru Sapozhnikov Philipp V. ORCID – https://orcid.org/0000-0002-3239-6543 Shirshov Institute of Oceanology RAS, Moscow, Russia fil_aralsky@mail.ru Snigirova Anastasiya A. ORCID – https://orcid.org/0000-0003-4501-3860 Institute of marine biology of the NAS of Ukraine, Odessa, Ukraine snigireva.a@gmail.com Salimon Alexey I. ORCID – https://orcid.org/0000-0002-9048-8083 National University of Science and Technology MISIS, Moscow, Russia; Skolkovo Institute of Science and Technology, Moscow, Russia a.salimon@skoltech.ru Kaliaeva Yaroslava V. ORCID – https://orcid.org/0000-0002-7974-1623 Skolkovo Institute of Science and Technology, Moscow, Russia J.kalyaeva@gmail.com
ARTICLE LINK: Kalinina O.Yu., Sapozhnikov Ph.V., Snigirova A.A., Salimon A.I., Kaliaeva Ya.V. The use of plastic details to increase the contact surface of the substrate during the cultivation of attached species of algae. Voprosy sovremennoi algologii (Issues of modern algology). 2021. № 1 (25). P. 110–123. URL: http://algology.ru/1628 DOI – https://doi.org/10.33624/2311-0147-2021-1(25)-110-123 When reprinting a link to the site is required
На ГЛАВНУЮ
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ
|
|||
|
| ||