|
|
|
Влияние органических загрязняющих веществ на рост динофитовых микроводорослей
Ерохин В.Е., Гордиенко А.П. Vladislav E. Erokhin, Alla P. Gordienko
Федеральный исследовательский центр
УДК 57.083.1:574.64
Обобщены результаты экспериментов с динофитовыми водорослями Prorocentrum cordatum. В культуральной среде с добавкой мидийного гидролизата наблюдали эффекты стимуляции роста водорослей, а также снижения токсического действия фенола. Эффекты проявлялись при концентрациях гидролизата от 0,05 до 0,5 мг∙л-1 в перерасчете на белок и концентрациях фенола до 10 мг∙л-1. Одной из причин стимуляции роста P. cordatum в темноте и освещенности от 17 мкЭ∙м-2∙с-1 до 100 мкЭ∙м-2∙с-1 является миксотрофия. Установлено, что фенол в концентрации от 0,25 до 10 мг∙л-1 также стимулирует рост динофитовых водорослей. Ключевые слова: Prorocentrum cordatum; рост; мидийный гидролизат; фенол.
Введение При разработке экологических мероприятий по оздоровлению и реабилитации морских экосистем одной из актуальных задач является поиск и селекция толерантных к токсикантам видов микроводорослей с целью выявления механизмов устойчивости их к токсическому воздействию. Динофитовые водоросли играют значительную роль в функционировании морских экосистем, а сведений по влиянию на них растворенных в воде трофически ценных и токсичных органических загрязнений, например фенольных соединений, практически не имеется. Скорее всего, причина слабой изученности этих микроводорослей связана с особенностями их культивирования и миксотрофного метаболизма (Ерохин и др., 2011; Єрохін та iншi, 2014). Например, при возникновении отрицательно влияющих на фотосинтез факторов и при наличии в среде органических веществ, динофлагелляты переходят на гетеротрофный механизм энергообеспечения (Ерохин, Голубь, 2008). Вещества фенольной природы имеют различные механизмы взаимодействия при автотрофном и гетеротрофном способах питания, что не только осложняет технику постановки эксперимента, но и снижает достоверность получаемых данных. Целью настоящей работы явилось обобщение исследований авторов по экспериментальной оценке влияния растворенных в воде трофически ценных и токсичных органических загрязнений на динамику роста морских динофитовых микроводорослей.
Материалы и методы Известно, что при загрязнении морской среды наиболее существенные повреждения испытывают первичные продуценты органического вещества и начальные звенья пищевой цепи. Исходя из этого, опыты проводили на альгологически чистых культурах динофитовой (Dinophyta) микроводоросли Prorocentrum cordatum (Ostenfeld) J.D. Dodge, 1975, взятых из коллекции отдела экологической физиологии водорослей ФИЦ ИнБЮМ РАН. Микроводоросли выращивали при естественном освещении в лаборатории, обеспечивая уровень освещения культур от 17 до 100 мкЭ·м-2·с-1. Температура во время проведения серии опытов составляла от +18 до +26оС. Накопительную культуру выращивали в конических колбах емкостью 200 мл, разводя плотную культуру средой для опыта до 0,1 ед. оптической плотности, измеренную в 20 мм кювете при 670 нм на кфк-2. Каждый опыт проводили в трех параллельных вариантах. Пробы в каждом варианте отбирали в трёх аналитических повторностях. Колбы с культурами помещали на световую решетку с заданной интенсивностью освещения. Эксперименты при отсутствии освещения проводили в светонепроницаемом боксе. В качестве модельных трофически ценных растворённых в морской воде органических загрязнений нами использован щелочной мидийный гидролизат, который имитировал в экспериментах поступающее в воду в результате деструкции и физико-химического выщелачивания органического вещества отмирающих организмов. Способ получения гидролизата разработан одним из авторов (Єрохін, Голуб, 2003). В нем содержатся основные группы органических веществ морского генеза, имеющие трофическую ценность – аминокислоты, производные белков, углеводов, липидов и т.д. (Ерохин, 2005). Использованные в опытах концентрации общего азота составляли в пересчёте на белок от 0,05 до 0,5 мг на литр среды, что близко к содержанию растворённых в морской воде органических веществ в летний период. Кроме того, данные концентрации растворов не мешают фотоколориметрированию культур. Для приготовления культуральной среды применяли пастеризованную морскую воду с мидийным гидролизатом, а также фенольные соединения в заданных концентрациях. Концентрацию фенола в опыте задавали заведомо выше, чем в природе, с целью определения ее лимитирующего уровня. Анализ полученных данных проводили в сравнении с контрольными культурами, выращиваемыми только на морской воде, на морской воде при добавке гидролизата, или на морской воде с добавкой фенольных соединений. Такой подход позволил вычленять влияние исследованных факторов на рост динофлагеллят. Измерения характеристик роста водорослей проводили один раз в сутки. Для экспериментального выращивания использовали различные вариации и соотношения задаваемых концентраций фенола и гидролизата. Определение концентрации клеток в культуре микроводорослей проводили стандартным способом прямого учета в камере Горяева и колориметрическим методом с построением калибровочной кривой. Культуры в контроле выращивали либо на среде Гольдберга в модификации Ю.Г. Кабановой, либо на пастеризованной морской воде. В опытах использовали аналогичную среду с добавлением мидийного гидролизата до конечной концентрации белка 0,5 мг·л-1 и различных концентраций фенола.
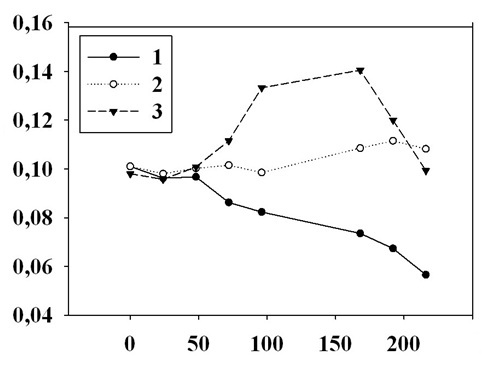
Результаты и обсуждение Исследовано влияние добавок растворённых в воде модельных органических трофически ценных загрязнений на рост динофитовых микроводорослей в темноте и при различных уровнях освещения. На рис. 1 представлены данные по динамике роста культур в одном из экспериментов. Эти результаты показывают стимулирование роста культуры P. cordatum при добавке в морскую воду щелочного гидролизата мидий в концентрациях 0,05 мг·л-1 и 0,5 мг·л-1. Увеличение количества клеток в культуре происходило до исчерпания субстрата на 7 сутки роста в темноте, что свидетельствует о способности P. cordatum к гетеротрофному типу питания. Имеются данные, что клетки P. minimum ассимилируют азот из состава растворенного органического вещества за короткий период (менее 5 дней) и эффективность потребления этого источника азота для роста сопоставима с тем, когда водоросли использовали нитрат, аммоний или мочевину (Ou et al., 2014). Авторы указывают, что P. minimum обладает адаптивной физиологией в субоптимальных условиях и является конкурентоспособным видом цветения.
Рис. 1. Рост культур P. cordatum в темноте, в гетеротрофных условиях при добавке щелочного гидролизата мидий в концентрациях 0,05 мг·л-1 (2); 0,5 мг·л-1 (3) и в контроле на морской воде (1). На оси абсцисс указаны сроки культивирования водорослей в часах, а на оси ординат – количество клеток в культуре в относительных единицах Fig. 1. Growth of P. cordatum cultures in darkness in heterotrophic conditions with the addition of mussel alkaline hydrolyzate in concentrations of 0.05 mg·l-1 (2); 0.5 mg·l-1 (3) as well as in seawater control (1). The abscissa axis shows the time of algae cultivation in hours, and the ordinate axis shows the number of cells in the culture in relative units
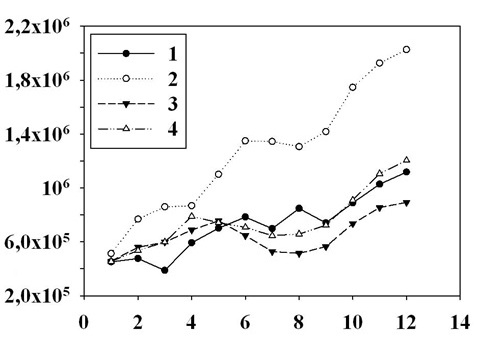
Способность использовать растворённый органический углерод и азот в течение дня и ночи может позволить миксотрофным организмам конкурентное преимущество в период цветения перед сопутствующими видами фитопланктона, которые ограничены фотоавтотрофным ростом, получая неорганические формы биогенных элементов в течение дня и в хорошо освещенных поверхностных водах (Mulholland et al., 2018). Обнаружено, что культура P. cordatum при отсутствии освещения и доступных органических трофически ценных веществ, вероятно, может переходить в период покоя, так как численность клеток при высокой концентрации фенола в среде достаточно длительное время не изменяется. При продолжительной экспозиции, превышающей 15 суток, вновь наблюдали увеличение роста численности клеток. Последнее может быть вызвано утилизацией сопутствующей бактериальной микрофлорой избыточной концентрации фенолов с переработкой их в доступные для микроводорослей соединения. В экспериментах по динамике роста динофлагеллят в накопительных культурах, в условиях различной освещенности и при добавках модельных органических трофически ценных загрязнений в форме щелочного гидролизата мидий и при воздействии фенольных соединений, отмечены следующие эффекты. Во-первых, добавка в питательную среду щелочного гидролизата мидий, моделирующего растворенные в морской воде органические вещества, вызывала стимулирование роста культуры P. cordatum при всех исследованных концентрациях в темноте и при различных уровнях освещения. Высокие концентрации фенола (100 мг·л-1) были токсичными для P. cordatum. Следует отметить, что даже при такой концентрации фенола в первые трое суток эксперимента отмечен незначительный рост водорослей. При продолжении эксперимента наблюдали снижение темпа деления, клетки теряли подвижность, оседали на дно, но при этом сохраняли клеточную оболочку и органеллы. Более низкие концентрации фенола (1–10 мг·л-1) стимулировали рост культуры P. cordatum. Как стимулирующее, так и ингибирующее влияние фенола на рост культур микроводорослей зависело от концентрации токсиканта. Этот эффект можно объяснить непосредственной утилизацией фенола микроводорослями, либо утилизацией и деструкцией фенола сопутствующей бактериальной микрофлорой. В этом случае, потребление продуктов трансформации фенола может происходить либо путем утилизации растворенной органики, либо путем захвата сопутствующих бактериальных клеток. Следует отметить, что указанное предположение требует экспериментальной проверки. На рис. 2 показан характер роста культур P. cordatum в различных средах. Как видно, наиболее сильный стимулирующий эффект проявился при добавке в морскую воду 0,5 мг·л-1 щелочного гидролизата мидий. Добавка 0,5 мг·л-1 и 0,25 мг∙л -1 фенола в морскую воду не приводила к гибели культур в течение 12 суток, а в первые пять суток опыта рост P. cordatum выше, чем на морской воде без добавок.
Рис. 2. Рост культур P. cordatum на морской воде (1), на морской воде с добавкой 0,5 мг·л-1 щелочного гидролизата мидий (2), а также на морской воде с добавкой 0,5 мг·л-1 (3) Fig. 2. Growth of P. cordatum cultures in seawater (1), in seawater with the addition of 0.5 mg·l-1 mussel alkaline hydrolysate (2), and in seawater with 0.5 mg·l-1 (3) and 0.25 mg·l-1 (4) phenol. The light intensity is 100 µE·m-2·s-1. The abscissa axis is the terms of algae cultivation in days, the ordinate axis is the number of cells in the culture in relative units
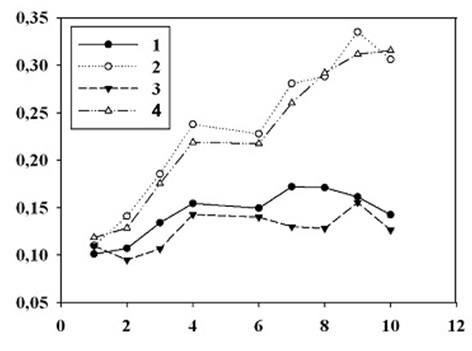
На рис. 3 показана динамика роста культур P. cordatum на различных культуральных средах. Как видно, рост на морской воде (1) и на морской воде с добавкой 0,1 мг·л-1 щелочного гидролизата мидий (2) значительно отличаются, т.к. гидролизат стимулирует рост водорослей при освещении 100 мкЭ·м-2·с-1. Наиболее вероятно, что в данном случае водоросли используют не только автотрофный, но и гетеротрофный способ энергообеспечения. Кривые 3 и 4 на рис. 3 подтверждают предположение, что при наличии в среде трофически ценных органических веществ повышается устойчивость динофлагеллят к токсическому действию фенольных соединений. Экспериментально подтверждено, что фенол в концентрации от 0,25 мг·л-1 до 10 мг·л-1 стимулирует рост динофитовых водорослей. Механизм этого эффекта остается неясным.
Fig. 3. P. cordatum culture growth in seawater (1), in seawater with 0.1 mg·l-1 mussel alkaline hydrolysate (2), in seawater with 0.75 mg·l-1 phenol (3), as well as in seawater with 0.1 mg·l-1 mussel alkaline hydrolysate and 0.75 mg·l-1 phenol (4). The light intensity is 100 µE·m-2·s-1. The abscissa axis is the terms of algae cultivation in days, the ordinate axis is the optical density of cultures in relative units
Наиболее характерным показателем потребления растворенной органики могут служить изменения в темпе деления культур микроводорослей. Широкий спектр органических веществ гидролизата и их сбалансированный состав – органические формы углерода, азота, фосфора, витаминов и микроэлементов – утилизируются фитопланктоном, не только в качестве энергетического, но и пластического материала, что приводит к ускорению темпа деления. Полученные данные показывают, что в культуре P. cordatum, которая потребляла гидролизат в течение всего опыта, темп деления клеток увеличился более, чем вдвое по сравнению с контролем, растущим на среде Гольдберга. Значительный интерес представляет способность микроводорослей P. cordatum расти на органических веществах гидролизата в темноте. При этом на рост культур влияют концентрация растворенных веществ, плотность клеток в инокуляте и другие факторы, которые необходимо учитывать, нормировать, а в некоторых случаях адаптировать, например, к новому субстрату. Указанный эффект достигается в результате выравнивания физиолого-биохимических параметров за счёт адаптации культур динофитовых водорослей к условиям гетеротрофного метаболизма. Адаптацию осуществляют путем предварительного культивирования микроводорослей в темноте на питательных средах с мидийным гидролизатом до выхода культур на экспоненциальную фазу роста (Єрохін та iншi, 2014). Для уточнения влияния органических трофически ценных веществ при сочетании действия гидролизата и фенолов на культуральных средах, имитирующих загрязнение разными типами органических веществ, были поставлены специальные эксперименты. Основная задача этих опытов сводилась к проверке гипотезы о том, что при достаточном содержании в среде трофически ценных органических веществ, токсическое действие фенольных соединений на динофлагеллят снижается. Получены данные по динамике роста динофитовой водоросли P. cordatum при сочетанном действии гидролизата и фенола. На фоне добавки в культуральную среду 0,5 мг·л-1 щелочного гидролизата мидий и освещении 100 мкЭ·м-2·с-1, исследованы как низкие концентрации фенола (0,25; 0,5; 0,75 мг·л-1), так и высокие (10 мг·л-1 и 100 мг·л-1). На свету наблюдали стимулирование роста микроводорослей, по сравнению с контролем на морской воде в вариантах опыта на морской воде с добавкой 0,5 мг·л-1 щелочного гидролизата мидий, а также при добавке фенола в концентрации 10 мг·л-1 в культуральную среду, содержащую 0,5 мг·л-1 щелочного гидролизата мидий. При концентрации фенола 100 мг·л-1 на фоне содержания в среде 0,5 мг·л-1 щелочного гидролизата мидий, рост водорослей ингибировался. В заключение следует отметить, что наша гипотеза о влиянии трофически ценных органических веществ на снижение токсического действия фенольных соединений для исследованных видов динофлагеллят была подтверждена. Тем не менее, полученные данные свидетельствуют о необходимости дальнейших исследований, направленных на понимание механизма взаимодействия не только органических соединений различного типа, но и формирование ответной реакции основных компонентов экосистемы, в первую очередь бактериальной микрофлоры и микроводорослей, направленной на устойчивость экосистемы к антропогенным воздействиям. Вполне очевидно, что при массовом цветении фитопланктона в эвтрофированных акваториях возможна реализация пластичного механизма энергообеспечения некоторых планктонных водорослей. Исходя из способности планктонных водорослей к миксотрофному метаболизму, следует учитывать в трофодинамических расчетах их вклад в формирование замкнутого цикла углерода и других биогенныех элементов в экосистемах. Результаты исследования могут быть использованы при разработке рекомендаций по улучшению состояния окружающей среды, например, путем обогащения трофически ценными растворенными органическими веществами акватории, загрязненной выбросом фенолов. Кроме того, полученные данные могут найти применение в биотехнологии для разработки методов стимулирования роста культур микроводорослей.
Выводы – Показан стимулирующий, а также снижающий токсическое действие фенола эффект взаимодействия динофитовых водорослей Prorocentrum cordatum и мидийного гидролизата при концентрациях от 0,05 до 0,5 мг∙л-1 в перерасчете на белок. – Длительность поддержания роста водорослей в темноте, за наблюдаемый период культивирования, определяется концентрацией в питательной среде трофически ценных растворенных органических веществ. – Установлено, что низкие концентрации растворенных органических веществ при освещении способны использоваться в качестве эффективного питательного субстрата, что является одной из причин стимуляции роста P. cordatum в условиях освещенности 17 мкЭ∙м-2∙с-1 и 100 мкЭ∙м-2∙с-1 и может быть объяснено наличием миксотрофии у этих водорослей. – Экспериментально подтверждено, что фенол в концентрации от 0,25 до 10 мг∙л-1 стимулирует рост динофитовых водорослей. Механизм этого эффекта остается неясным.
Благодарности. Авторы выражают искреннюю благодарность сотруднице ОЭФВ ФГБУН ФИЦ ИнБЮМ О.Р. Солонициной за содействие в предоставлении культур водорослей и участие в экспериментальной работе. Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье. Работа выполнена по государственному заданию в рамках темы АААА-А18-118021490093-4 «Функциональные, метаболические и токсикологические аспекты существования гидробионтов и их популяций в биотопах с различным физико-химическим режимом» и темы АААА-А18-118020790229-7 «Структурно-функциональная организация продуктивности и устойчивости пелагических экосистем».
Список литературы
Статья поступила в редакцию 11.12.2019
Об авторах Ерохин Владислав Евстафьевич – Erokhin Vladislav E. кандидат биологических наук, доцент veerokhin@gmail.com Гордиенко Алла Павловна – Gordienko Alla P. кандидат биологических наук, доцент apgord@gmail.com Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФИЦ ИнБЮМ; тел. (8692)-54-41-10.
ССЫЛКА НА СТАТЬЮ: Ерохин В.Е., Гордиенко А.П. Влияние органических загрязняющих веществ на рост динофитовых микроводорослей // Вопросы современной альгологии. 2019. № 3 (21). С. 48–55. URL: http://algology.ru/1573 DOI - https://doi.org/10.33624/2311-0147-2019-3(21)-48-55
Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
Influence of organic pollutants on the growth of dinophytic microalgae Vladislav E. Erokhin, Alla P. Gordienko FIC «Kovalevsky Institute of Biology of the Southern Seas RAS» (Sevastopol, Russia) The results of experiments with dinophytic algae Prorocentrum cordatum are summarized. The algae growth stimulation as well as the reduction of phenol toxic effect in the culture medium with the added mussel hydrolyzate was observed. These effects were obtained at hydrolyzate concentrations from 0.05 to 0.5 mg∙l-1 in recalculation of protein and phenol concentrations up to 10 mg∙l-1. One of the reasons for P. cordatum growth stimulation in darkness and light intensity from 17 μE m-2 s-1 to 100 μE∙m-2∙s-1 is myxotrophy. It was found that phenol in a concentration from 0.25 to 10 mg∙l-1 stimulates the growth of dinophytic algae. Key words: Prorocentrum cordatum; growth; mussel hydrolysate; phenol.
References
Authors Erokhin V.E. ORCID - https://orcid.org/0000-0001-8001-9702 FIC «Kovalevsky Institute of Biology of the Southern Seas RAS», Sevastopol, Russia veerokhin@gmail.com Gordienko A.P. ORCID - https://orcid.org/0000-0003-2305-6579 FIC «Kovalevsky Institute of Biology of the Southern Seas RAS», Sevastopol, Russia apgord@gmail.com
ARTICLE LINK: Erokhin V.E., Gordienko A.P. Influence of organic pollutants on the growth of dinophytic microalgae. Voprosy sovremennoi algologii (Issues of modern algology). 2019. № 3 (21). P. 48–55. URL: http://algology.ru/1573 DOI - https://doi.org/10.33624/2311-0147-2019-3(21)-48-55
Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free. When reprinting a link to the site is required
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||