|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VII Сабининские чтения 1 ноября - 25 декабря 2018 г. Содержание биохимических компонентов в морской микроводоросли Tetraselmis viridis при длительном хранении в состоянии холодового анабиоза
Харчук И.А., Береговая Н.М. Irina A. Kharchuk, Natalia M. Beregovaya
Институт морских биологических исследований им. А.О. Ковалевского РАН
УДК 582.263:57.086.13
Выявлено, что при длительном хранении зеленой микроводоросли Tetraselmis viridis более 7 лет при температуре -14ºС в пробах без протекторов наблюдается снижение биохимических показателей (пигментов, липидов, белка, углеводов) на 70–90% от первоначального количества, а в пробах, сохраняемых с протекторами (глицерин 10, 20 и 30%), – на 30–60%. Однако соотношение биохимических компонентов в клетках сохраняется, что предполагает сохранение биологической ценности микроводоросли и ее способности к реактивации. Ключевые слова: микроводоросли; метод сохранения; замораживание; Tetraselmis viridis; биохимический состав.
Введение Использование микроводорослей и продуктов их метаболизма в исследовательских и народно-хозяйственных целях непрерывно расширяется. Различные виды водорослей сегодня служат источниками растительного белка, витаминов, хлорофилл-каротиноидных комплексов, ценных эфирных масел, стеринов, цитохромов, препаратов бактерицидного действия, иммуностимулирующих соединений и других веществ. Продукты из микроводорослей эффективно применяются в качестве кормовых добавок сельскохозяйственным животным, разнообразным водным организмам, используются в парфюмерии и фармакологии, медицине и микробиологии. Значительна также регенерационная и трофическая роль микроводорослей в естественных и искусственных экологических системах, в том числе включающих человека и его производственную деятельность. Морская зеленая микроводоросль Tetraselmis viridis довольно широко используется в биотехнологии и марикультуре. Ценность ее определяется содержанием биологически активных веществ, необходимых для полноценного развития и жизни гидробионтов. Спектр применимости микроводорослей складывается из использования самой биомассы и биомассы как сырья для получения каких-либо ценных веществ. Возникает вопрос: как сохранить клетки водорослей с заданными свойствами? Известно, что хранение при отрицательных температурах обеспечивает долгосрочное сохранение культур с поддержанием высокой жизнеспособности и предупреждает мутационные изменения, то есть это состояние максимально близко к естественному (Сидякина, 1991). Консервация микроводорослей с протекторами путем замораживания позволяет сохранять их длительное время (Харчук, 2017). Цель данной работы: исследовать влияние протектора разной концентрации на содержание биохимических компонентов в клетках зеленой микроводоросли Tetraselmis viridis при длительном хранении и отрицательной температуре (минус 14ºС).
Материал и методы Объектом исследования служила культура Tetraselmis viridis (штамм IBSS–25) из коллекции Отдела биотехнологии и фиторесурсов ИМБИ РАН. Микроводоросли культивировали в накопительном режиме, при постоянном круглосуточном освещении и автоматическом перемешивании с использованием насоса для удаления избытка кислорода из среды и равномерного прогрева всего слоя питательного раствора культуры. Интенсивность света на поверхности раствора составляла 8 кЛк. Температура среды колебалась в диапазоне 25–29°С. В качестве питательной среды для T. viridis использовали среду Тренкеншу (Тренкеншу, 1984). Объем среды в культиваторах составлял 1 л при высоте слоя раствора 45 см. На стационарной фазе роста культуру микроводорослей разделяли на шесть равных частей, три из которых концентрировали с помощью центрифугорования при 3000 об./мин на лабораторной центрифуге ОПН–3-УХЛ 42. Питательную среду удаляли. К первой части добавляли 1% глюкозу, ко второй – 1% сахарозу, к третьей части ничего не добавляли. Пасту водорослей помещали в герметичные пластиковые боксы и ставили в морозильную камеру (-14ºС). К оставшимся трем частям добавляли глицерин, конечная концентрация которого составляла 10, 20 и 30%. Клетки продолжали культивировать еще в течение 48 ч. Затем проводили концентрирование клеток и закладку на длительное хранение как описано выше. Перед замораживанием проводили биохимические исследования. Влажность в обезвоженных культурах определяли стандартным методом доведения до постоянной массы (Топачевский, 1975). Пробы обрабатывали по схеме комплексного химического анализа гидробионтов (Копытов и др., 1985). Массовую долю белка в водорослях определяли по методике Лоури (Lowry et al., 1951), содержание пигментов – спектрофотометрическими методами на приборе СФ-2000 (Рубин, 1975; Rowan, 1989). Общее содержание липидов находили спектрофотометрическим методом с фосфованилиновым реактивом (Агатова и др., 2004). Определение углеводов проводили по методике Агатовой А.И. с соавт. (2004) с L-триптофановым реактивом (Агатова и др., 2004). Регистрируемые показатели химического состава выражали в пересчете на сухую массу. В процессе хранения водоросли периодически реактивировали и определяли долю клеток, сохранивших свою жизнеспособность, а также проводили биохимический анализ.
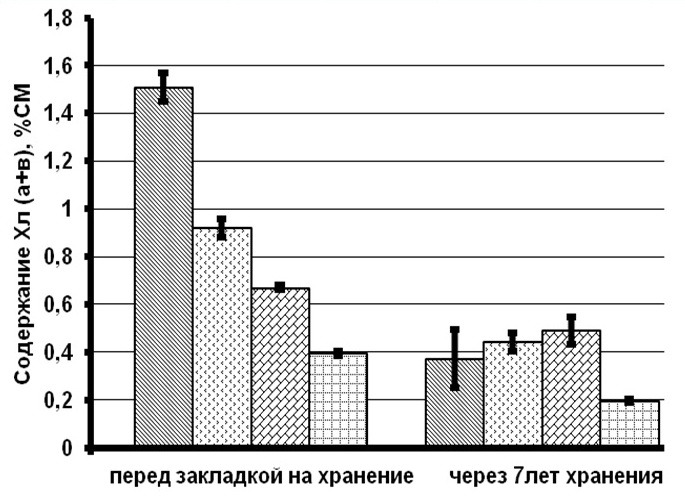
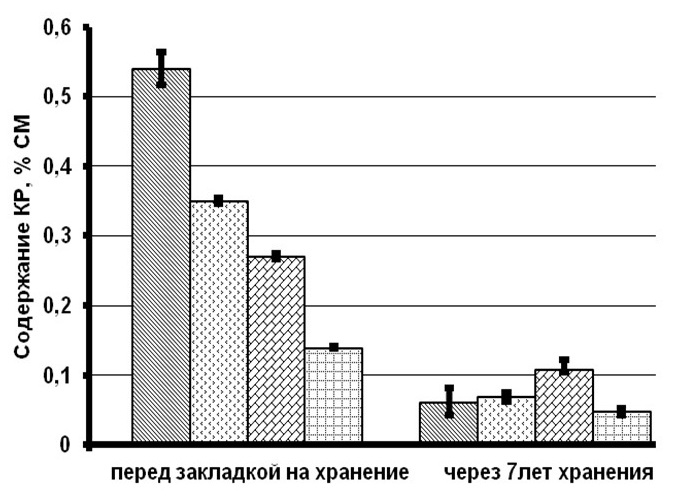
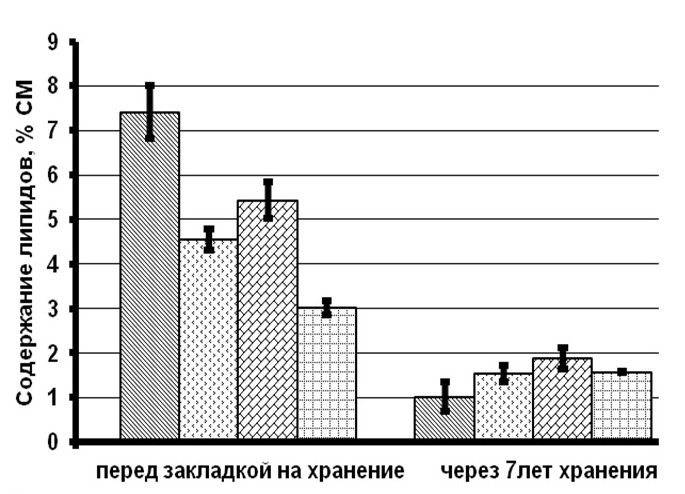
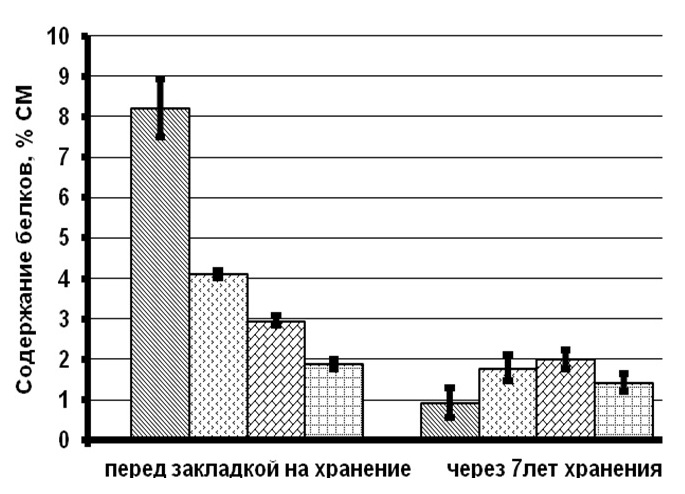
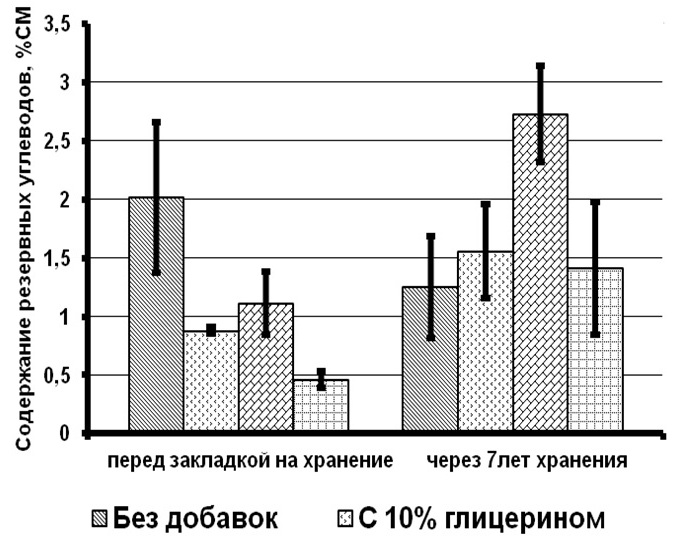
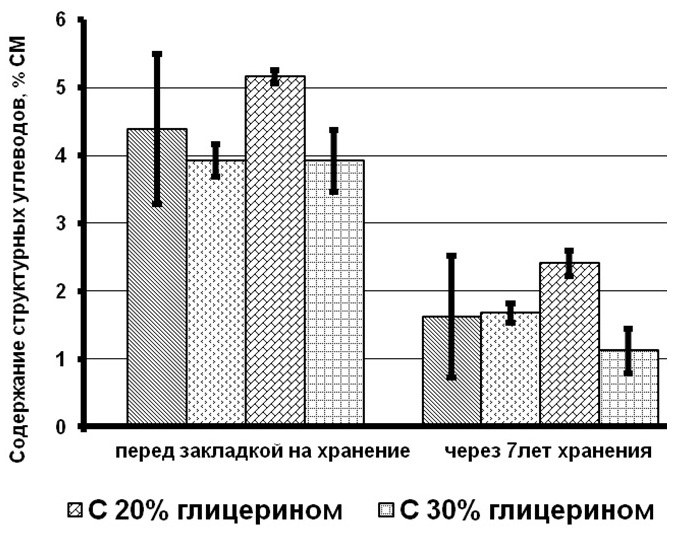
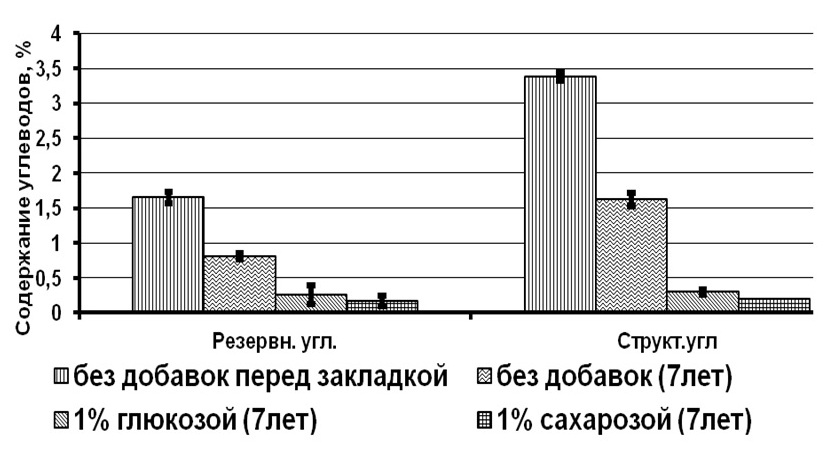
Результаты и обсуждение При сравнении биохимических показателей клеток T. viridis перед закладкой на длительное хранение выявлена динамика снижения количества пигментов (хлорофиллов и каротиноидов), липидов и белков с увеличением концентрации вносимого протектора. Содержание резервных углеводов в клетках с протекторами было ниже, чем в контроле на 56–76%, в то время как количество структурных углеводов статистически не менялось (рис. 1). Данное явление связано с внесением глицерина в культуру и способностью клеток T. viridis переходить на миксотрофный способ питания, подобная способность описана и у других зеленых одноклеточных водорослей (Liang et al., 2009; Kong et al., 2013; Жондарева, Тренкеншу 2016). После добавления глицерина в течение 3–5 дней отмечается снижение роста культуры (Жондарева, Тренкеншу, 2016), что сказывается на биохимических показателях. Через 7 лет пребывания в морозильной камере в клетках зеленых водорослей отмечено снижение суммарных хлорофиллов на 26–75% от первоначальных концентраций, каротоноидов – на 60–88%, липидов – на 47–86%, белков – на 24–88%, структурных углеводов – на 53–71%. Относительно высокое содержание всех биохимических компонентов зарегистрировано в культуре, сохраняемой с глицерином 20% концентрации.
Рис.1. Содержание биохимических компонентов в клетках зеленой микроводоросли Tetraselmis viridis Fig.1. The content of biochemical components in the cells of green microalgae Tetraselmis viridis depending on the used protector and the duration of storage (Хл (а+в) – total chlorophylls, КР – carotenoids)
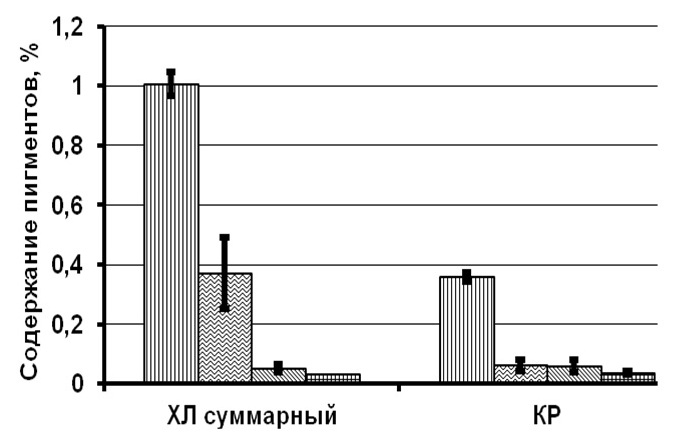
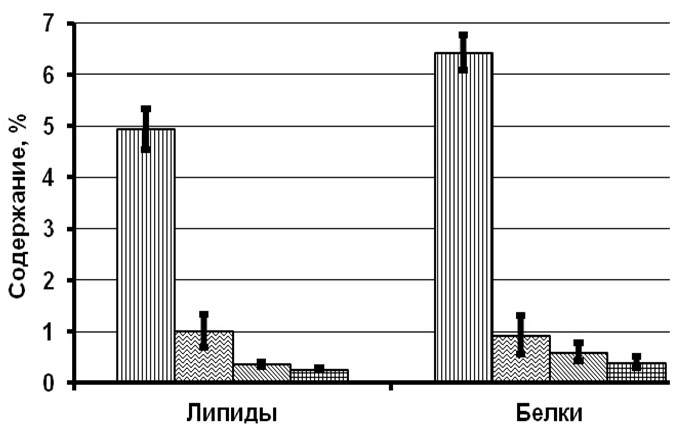
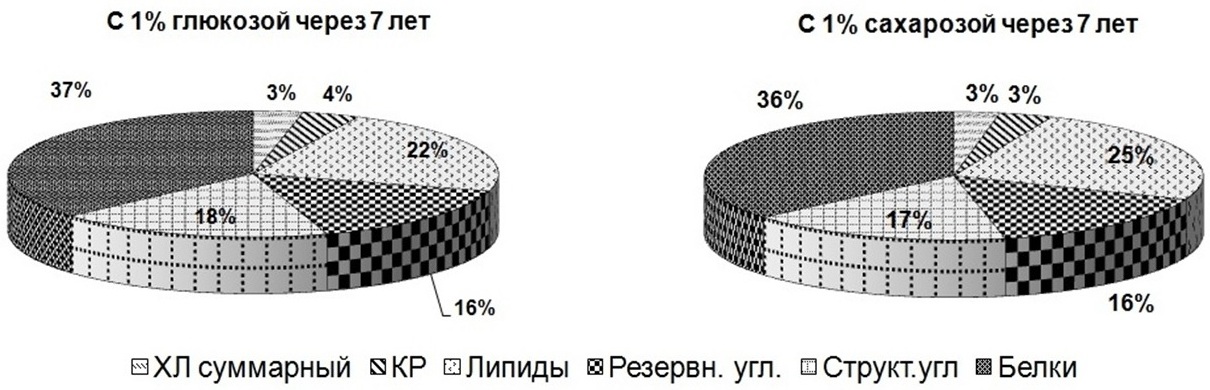
Совершенно по-другому выглядят результаты исследований клеток T. viridis, сохраняемых в течение 7 лет с растворами 1%-ной глюкозы и сахарозы в качестве протекторов (рис. 2). Отмечено снижение суммарных хлорофиллов на 62–96% от первоначальных концентраций, каротиноидов – на 60–88%, липидов – на 79–82%, белков – на 85–94%, структурных углеводов – на 52–94%, резервных углеводов – на 51–89%. При этом показатели в пробах, сохраняемых без сахаров, выше на 20–40%.
Рис. 2. Содержание биохимических компонентов в клетках зеленой микроводоросли Fig. 2. The content of biochemical components in the cells of green microalgae Tetraselmis viridis when using 1% glucose and 1% sucrose as a protector for long-term storage
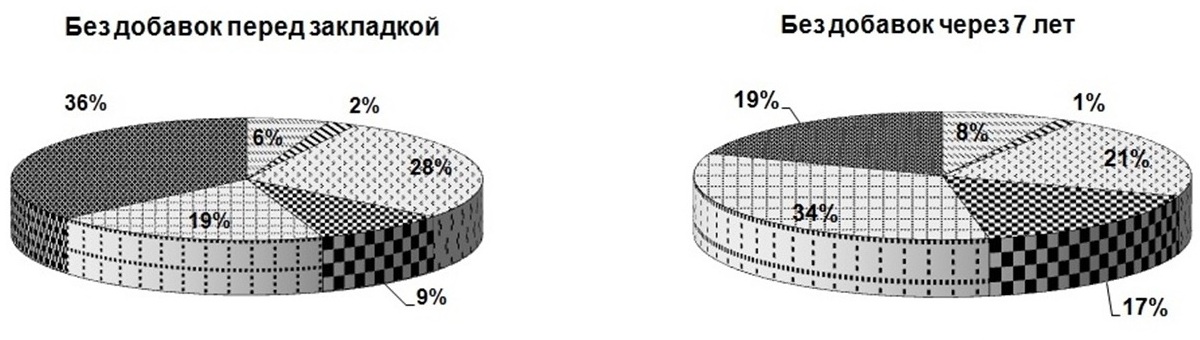
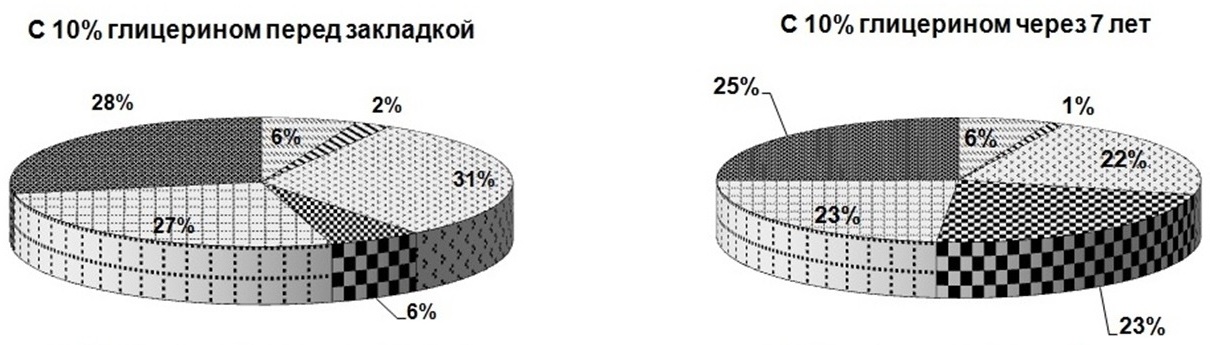
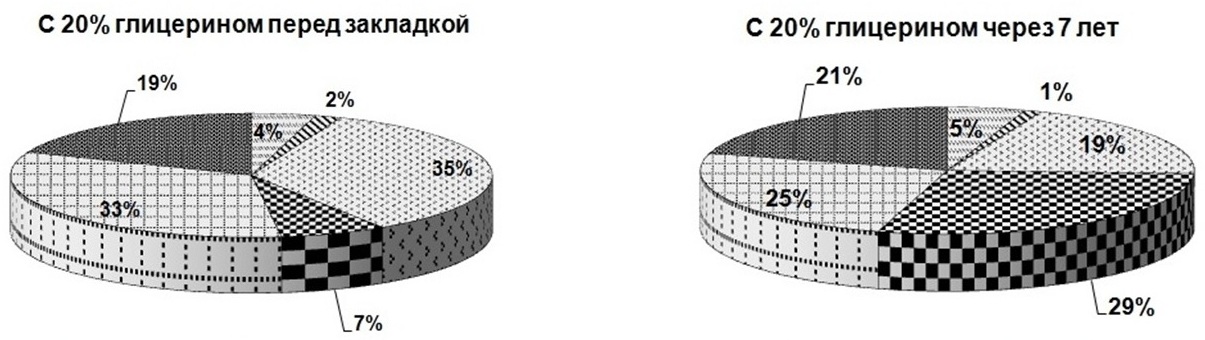
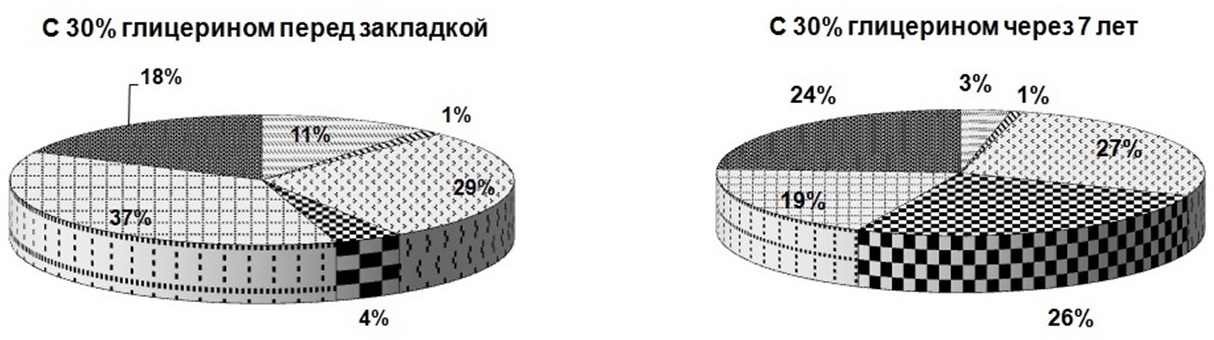
В эксперименте интересно было выявить, как меняется доля каждого биохимического компонента в составе клетки микроводоросли в зависимости от используемого протектора и срока хранения (рис. 3). Из рисунка видно, что через 7 лет хранения доля белков в пробах, сохраняемых с протекторами, оставалась без изменений, а в пробах без протекторов снижалась почти в 2 раза. На долю суммарных хлорофиллов повлияло добавление только 30%-ного глицерина (в этом случае их содержание снизилось в 3,5 раза), а также 1%-ной глюкозы и 1%-ной сахарозы (доля хлорофилла снизилась в 2 раза). Доля суммарных каротиноидов при использовании сахаров не менялась, в остальных случаях доля каротиноидов уменьшалась в 2 раза. Что касается липидов – без добавок их доля снижалась на 30%, при использовании в качестве протекторов 10 и 20%-ного глицерина уменьшение доли сокращалось почти в 2 раза, и только добавление 30%- ного глицерина, а также 1%-ной глюкозы и 1%-ной сахарозы затормозило процесс снижения доли липидов. Доля резервных углеводов увеличивалась в образцах без добавок и с добавлением экзоуглеводов – почти в 2 раза, при использовании глицерина 10, 20 и 30% – в 3, 4 и 6 раз соответственно. Доля структурных углеводов в пробах, сохраняемых с сахарами, практически не менялась; применение глицерина в качестве протектора снизило их долю: при добавке 10%-ного глицерина – в 1,2 раза, 20%-ного глицерина – в 1,3 раза, 30%-ного глицерина – в 2 раза. В пробах, сохраняемых без протекторов, доля структурных углеводов увеличивалась в 1,8 раза. Таким образом, применение протекторов положительно сказывается на сохранности соотношения биохимических компонентов в течение 7 лет хранения.
Рис. 3. Доли биохимических компонентов в клетках Tetraselmis viridis Fig. 3. Shares of biochemical components in the cells of Tetraselmis viridis depending on the protector used during long-term siorage (Хл (а+в) – total chlorophylls, КР – carotenoids)
Механизм действия глицерина на мембранном уровне не совсем ясен. Известно, что глицерин слабо влияет на свойства поверхности липидных монослоев и оказывает определенное действие на структуру мембраны. Глицерин в высоких концентрациях приводит к формированию новой гелевой фазы, в которой углеводородные хвосты липидов противоположных монослоев проникают друг в друга, что значительно снижает удельную емкость липидного слоя (Demel, Kruijff, 1976; Пушкарь и др., 1978). Отмеченное в эксперименте возрастание доли резервных углеводов можно объяснить разрушением клеточных оболочек в процессе хранения водорослей и переходом структурных углеводов в резервные. Сахароза и глюкоза являются не проникающими защитными веществами, которые при длительном хранении не способны защитить клеточные оболочки от повреждения, в результате произошла деструкция клеток и их содержимого. Реактивация T. viridis, пребывающего в течение 7 лет при температуре -14ºС, продлилась до 30 суток. Однако во всех пробах были обнаружены жизнеспособные клетки, которые после восстановления перешли к делению.
Заключение При длительном хранении Tetraselmis viridis более 7 лет при низкой температуре в пробах без протекторов отмечено снижение биохимических показателей (пигментов, липидов, белка, углеводов) на 70–90% от первоначального количества, а в пробах, сохраняемых с протекторами (глицерин 10, 20 и 30%), – на 30–60%. Однако, соотношение биохимических компонентов в клетках сохраняется, и, следовательно, клетки сохраняют способность к восстановлению жизнеспособности.
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье. Работа подготовлена по теме государственного задания ФГБУН ИМБИ «Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса», номер гос. регистрации АААА-А18-118021350003-6».
Список литературы
Статья поступила в редакцию 29.12.2018
Об авторах Харчук Ирина Алексеевна - Kharchuk Irina A. кандидат биологических наук seaferm@yandex.ru Береговая Наталия Михайловна - Beregovaya Natalia M. кандидат биологических наук beregovaya.53@mail.ru Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФГБУН ИМБИ; тел. (869)-2550795.
ССЫЛКА НА СТАТЬЮ: Харчук И.А., Береговая Н.М. Содержание биохимических компонентов в морской микроводоросли Tetraselmis viridis при длительном хранении в состоянии холодового анабиоза // Вопросы современной альгологии. 2019. № 1 (19). С. 88–95. URL: http://algology.ru/1431 DOI - https://doi.org/10.33624/2311-0147-2019-1(19)-88-95 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
The content of biochemical components in the marine microalgae Tetraselmis viridis during long-term storage in a state of cold hibernation Irina A. Kharchuk, Natalia M. Beregovaya Kovalevsky Institute of Marine Biological Research of RAS (Sevastopol, Russia) It was found that the storage of green microalgae Tetraselmis viridis for mire than 7 years at a temperature of -14ºС in samples without protectors there was a decrease in biochemical parameters (pigments, lipids, protein, carbohydrates) by 70–90% of the original quantity, and in samples stored with protectors (glycerin 10, 20 and 30%) characteristics decreased by 30–60%. However, the ratio of biochemical components in the cells was preserved, which implies the preservation of microalgae and its possibility to reactivation. Keywords: microalgae; methods of storage; freezing; Tetraselmis viridis; biochemical components.
References
Authors Kharchuk Irina A. ORCID – https://orcid.org/0000-0002-5771-2143 Kovalevsky Institute of Marine Biological Research of RAS, Sevastopol, Russia seaferm@yandex.ru Beregovaya Natalia M. ORCID – https://orcid.org/0000-0003-0233-164X Kovalevsky Institute of Marine Biological Research of RAS, Sevastopol, Russia beregovaya.53@mail.ru
ARTICLE LINK: Kharchuk I.A., Beregovaya N.M. The content of biochemical components in the marine microalgae Tetraselmis viridis during long-term storage in a state of cold hibernation. Voprosy sovremennoi algologii (Issues of modern algology). 2019. № 1 (19). P. 88–95. URL: http://algology.ru/1431 DOI – https://doi.org/10.33624/2311-0147-2019-1(19)-88-95
Dear colleagues! If you want to receive the version of the article in PDF format, write to the editor,please and we send it to you with pleasure for free. When reprinting a link to the site is required
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ 
|
||||||||||||||||
|
| |||||||||||||||