|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VI Сабининские чтения 1 ноября - 15 декабря 2017 г. Харовые водоросли в оценке токсичности фенолов сточных вод
Плеханов С. Е., Братковская Л.Б. Sergey E. Plekhanov, L’ubov B. Bratkovskaya
Московский государственный университет имени М.В. Ломоносова,
УДК 574.632:582.263
Первичные функциональные реакции водорослей на фенолы сточных вод определяются, во-первых, их взаимодействием с клеточной оболочкой и плазмалеммой, что вызывает нарушение проницаемости и далее с цитоплазмой, скорость движения которой является объективным показателем физиологического состояния клеток и является энергозависимой. Фенолы в низких концентрациях вызывают в основном обратимые изменения в скорости движения протоплазмы клеток. При высоком содержании наблюдается подавление движения протоплазмы, снижение разности электрических потенциалов, сопротивления внешней мембраны до близких к нулю значений, остановка движения протоплазмы и гибель клеток. Ключевые слова: фенолы; водоросли Nitella; движение протоплазмы; электрофизиологические свойства.
Введение В настоящее время идет поиск общих закономерностей действия токсических веществ на водные организмы, популяции, модельные экосистемы по частным и интегральным характеристикам. Одновременно наблюдается стремление к использованию высокочувствительных аналитических методов обнаружения загрязняющих веществ в водной среде и биологических объектах и откликов биосистем на клеточном и субклеточном уровнях вплоть до уровня специфических мембранных структур и отдельных биохимических реакций (Рыбальский и др., 1993). Первичные процессы, происходящие при контакте загрязняющих веществ с клеточной оболочкой, плазмалеммой и далее с цитоплазмой, могут играть решающую роль в развитии структурных и функциональных нарушений в клетках водорослей. Движение протоплазмы является объективным показателем физиологического состояния клеток водорослей, и происходит в результате энергозависимого взаимодействия систем сократительных белков экто- и эндоплазмы. Функциональное состояние внешней мембраны при воздействии загрязнений отражается в изменениях специфичной K-Na и пассивной проницаемости, о чем свидетельствуют изменения разности электрических потенциалов, сопротивления внешней мембраны клеток Nitella. Использование гигантских клеток харовых водорослей может быть перспективным для экспресс-диагностики состояния клеток водорослей в условиях загрязнения, хотя интерес к таким подходам незаслуженно снижен по сравнению с 1980–1990 годами.
Материалы и методы В качестве объекта исследований использовали интернодальные клетки харовых водорослей Nitella syncarpa, Nitella sp. длиной 3–4 см, диаметром 0,2–0,3 мм. Водоросли культивировали на искусственной прудовой воде состава: 1M NaHCO3, 0,1мM KH2PO4, 0,2 мM Mg(NO3)2, 0,4 мM CaCl2 в аквариумах объемом 6 л при комнатной температуре и средней освещенности. Скорость движения протоплазмы (СДП) определяли в относительных единицах или мкм/сек методом оптической регистрации под бинокуляром МБС-2 с помощью окулярной сетки, калиброванной по объект-микрометру. Ошибка метода составляла 7%. Разность электрических потенциалов (РЭП) между вакуолью и внешним раствором, электрическое сопротивление (R) плазмалеммы исследовали с помощью стандартной микроэлектродной техники (Стом, 1982; Первис, 1983; Плеханов, 1999). Клетки перед опытом выдерживали в исходной питательной среде в течение суток, затем помещали в экспериментальную камеру, снабженную протоком для подачи исследуемых растворов. Обычное число опытов – 3–7. Результаты обрабатывали статистически с определением ошибки репрезентативности выборочной средней для малых выборок.
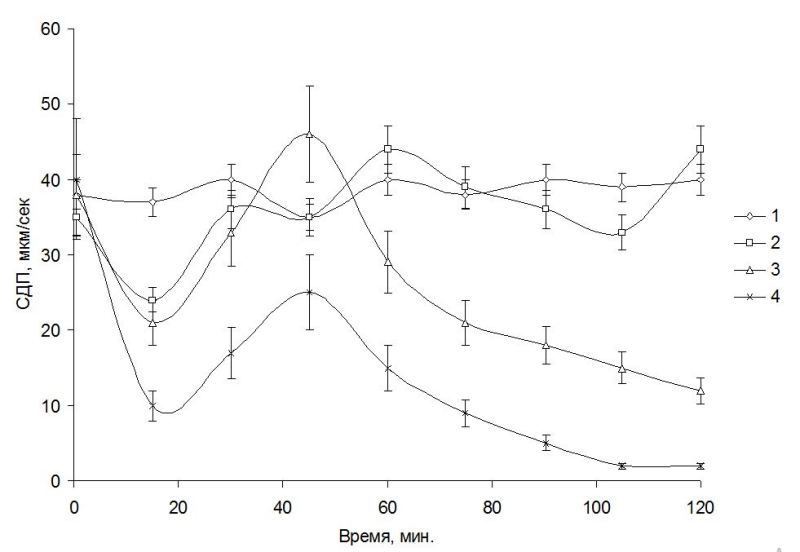
Результаты и обсуждение Гигантские клетки харовых водорослей, в частности рода Nitella, обитающие в чистых водах, перспективны как чувствительный тест-объект при отклонениях в химическом составе среды. Размеры клеток позволяют проводить на них электрофизиологические эксперименты как на модели растительного организма, что позволяет оценить in vivo барьерные возможности внешних мембран, определяющие, в свою очередь, последовательность адаптивных изменений, направленных на сохранение растительной клетки в изменяющихся условиях среды (Юрин и др., 1991). Процессы, происходящие при контакте загрязняющих веществ с клеточной оболочкой, плазмалеммой и далее с цитоплазмой, могут играть решающую роль в развитии структурных и функциональных нарушений в клетках водорослей. Взаимодействие химического загрязнения с растительной клеткой после главного барьера проницаемости продолжается в цитоплазме – внутренней среде, в которой функционируют внутриклеточные структуры. Движение цитоплазмы является объективным показателем физиологического состояния клеток харовых водорослей. Активность движения протоплазмы выражают через скорость движения гранул или величину движущей силы (Камия, 1962). Движение протоплазмы нуждается в затрате энергии АТФ, в использовании которой принимают участие АТФ-аза. Ротационное движение протоплазмы по современным представлениям определяется деятельностью субкортикальных фибрилл, а движущая сила энергетически зависима и возникает при взаимодействии систем сократительных белков экто- и эндоплазмы с участием АТФ-азы. Движение протоплазмы зависит от состояния актиновых и миозиновых нитей – белков, способных к смещениям, что, в свою очередь, происходит с затратой энергии АТФ. Актуальность загрязнения пресных вод фенолами особенно выражена в связи с загрязнением оз. Байкал стоками Байкальского ЦБК (Кожова, Бейм, 1993; Бейм, Грошева, 1996). При исследовании действия стоков Байкальского ЦБК и некоторых фенолов на СДП и биоэлектрические характеристики клеток харовых водорослей Nitella syncarpa, культивируемых в лабораторных условиях, было обнаружено, что в контроле (в протоке 0,1 мМ KCl) СДП практически не изменялась в течение всего времени наблюдений и составляла величину около 35 мкм/с. Реакция СДП клеток N. syncarpa на внесение в проток, омывающий клетку водоросли, сточной воды из пруда-аэратора Байкальского ЦБК и отдельных фенолов выразилась в сложных колебательных изменениях этого показателя (рис. 1). При этом первичные изменения СДП к 10–20 мин заключались в ее снижении при действии сточной воды или ФС, затем следовало увеличение СДП к 40–60 мин до уровня выше контрольного и далее наблюдали новое снижение СДП. При начальном подавлении СДП клеток водоросли в присутствии одного из токсикантов – сточной воды, фенола или пентахлорфенола (ПХФ) она составила 27, 20 и 10 мкм/сек соответственно, по сравнению с 33 мкм/сек в контроле. При действии воды из пруда-аэратора снижение СДП, увеличение его выше контроля, новое снижение и последующее увеличение до уровня, близкого к контролю, наблюдали до конца опыта. Начальное подавление СДП фенолом (1 мМ) сменялось стимуляцией до уровня выше контроля и далее – устойчивым подавлением до уровня 10 мкм/сек к 120 мин опыта. Рис. 1. Пример действия фенольных соединений и очищенного стока БЦБК на скорость движения протоплазмы водоросли Nitella syncarpa: 1 – контроль, 2 – вода из пруда-аэратора, 3 – фенол (1 мМ), 4 – ПХФ (0,01 мМ). Число клеток – 7.
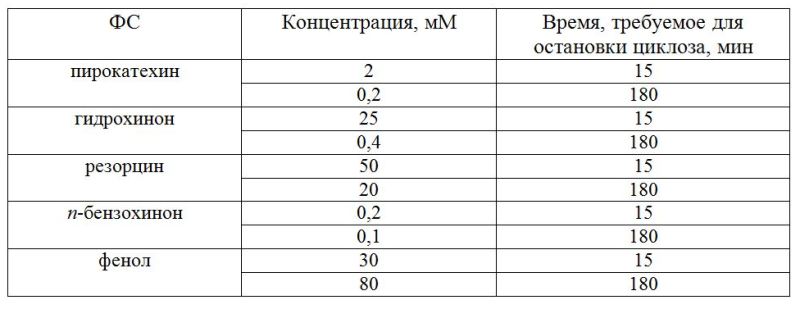
При действии ПХФ (0,01 мМ) начальное подавление СДП превышало таковое при действии фенола или сточной воды. В дальнейшем СДП в присутствии ПХФ частично восстанавливалась, не достигая контрольного уровня, и затем быстро снижалась почти до остановки движения гранул к 80 мин (рис. 1). Гидрохинон (0,01 мМ) действовал на СДП клеток N. syncarpa сходным образом с ПХФ, однако равное подавление СДП наблюдали лишь к 100 мин опыта. Дихлорфенол был менее токсичен, чем гидрохинон или ПХФ – при его концентрации 0,1 мМ СДП после фазы подавления и последующего роста до контрольного уровня, к 120 мин опыта имела величину, немного ниже контроля – 30 мкм/сек. По снижению степени подавления СДП водоросли N. syncarpa исследованные вещества можно расположить в ряд: ПХФ, гидрохинон, дихлорфенол, фенол. Вода из пруда-аэратора привела к уровню СДП, близкому к контролю, что указывает на достаточно эффективную очистку стоков Байкальского ЦБК. Из данных литературы известно, что в сточных водах Байкальского ЦБК фенолы содержатся в концентрации 0,05–0,1 мМ, что на 3–4 порядка выше фоновых в оз. Байкал (Бейм, 1983). Близкие результаты по подавлению СДП были получены нами для байкальских харовых водорослей Nitella sp. Кроме того, токсикометрические эксперименты, проведенные также на водоросли Nitella sp., показали, что остановка движения наблюдалась через 15 мин при действии следующих концентраций феноловых соединений (ФС): фенола – 30 мМ, гидрохинона – 25 мМ (табл. 1).
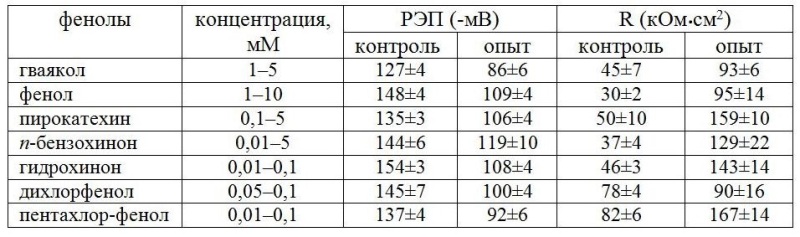
Таблица 1. Концентрации фенолов, при которых происходит остановка циклоза клеток водоросли Nitella sp. Можно предположить, что фазность в изменениях СДП определяется процессами образования и разрушения комплекса актомиозина, связанного с ресинтезом актина. Маловероятно, что действие фенолов на СДП связано с прямым воздействием на сократительные белки протоплазмы. Скорее всего, действие фенолов на СДП опосредовано их влиянием на энергетику клеток через снижение эффективности образования АТФ. Далее исследовали изменения разности электрических потенциалов (РЭП) и R клеток харовой водоросли N. syncarpa при действии фенолов стоков. В результате проведенных экспериментов было обнаружено, что добавление фенола (0,1 мМ) в раствор, омывающий клетку N. syncarpa, происходило снижение РЭП от -130 до -110 мВ, через 20 мин РЭП возрастала до -120 мВ (табл. 2). Увеличение содержания фенола до 0,5 мМ привело к незначительным колебаниям РЭП около уровня -120 мВ. Дальнейшее увеличение концентрации токсиканта (1 мМ) вызывало резкие колебания РЭП и быстрый спад до устойчивого уровня, близкого к калиевому равновесному потенциалу (-80 мВ). Фенол при концентрации 10 мМ приводил к быстрому падению РЭП почти до 0. Электрическое сопротивление системы вакуоль–среда при 0,1 мМ фенола после незначительного роста восстанавливалось до уровня, близкого к контролю. После увеличения концентрации фенола до 0,5 мМ R незначительно снижалось, но дальнейшее увеличение концентрации – до 1 мМ вызывало быстрый рост R в 3 раза относительно контроля, но при 10 мМ R падало почти до 0. Было показано, что многие из исследованных фенолов в определенном диапазоне концентраций снижают РЭП от -120 – -150 мВ до нового стационарного уровня, близкого к калиевому равновесному потенциалу. При этом R увеличивается с 30–80 до 90–160 кОм∙см2 (табл. 2). Обнаруженное снижение РЭП с одновременным увеличением R связано, очевидно, с подавлением активной составляющей РЭП из-за нехватки АТФ, вызванной действием фенолов. Резкое увеличение R в это время определяется, скорее всего, подавлением активных каналов проводимости на плазмалемме. Высокие концентрации ФС приводят к снижению РЭП и R практически до 0, что связано с нарушением пассивной проницаемости.
Таблица 2. Влияние фенолов на разность электрических потенциалов и сопротивление вакуоль–среда клеток Nitella syncarpa. Среда в контроле – 0,1 мМ KCl (число клеток 7)
Заключение Концентрации ФС, вызывающие снижение РЭП до нового стационарного уровня или до величин, близких к 0, соответствуют концентрациям, подавляющим СДП частично или полностью. По минимальной концентрации, вызывающей эффект снижения РЭП до нового стационарного уровня, фенолы образуют ряд по убыванию токсичности: пентахлорфенол, гидрохинон, дихлорфенол, пирокатехин, фенол. Полученные данные свидетельствуют, что харовые водоросли можно с успехом применять для целей биомониторинга природных или сточных вод. Быстро проникая в клетки водорослей, фенолы окисляются с образованием высокотоксичных хинонов и семихинонов, что определяет ряд их альготоксичности. Скорость движения протоплазмы может быть объективным показателем при экспресс-токсикометрии фенольного загрязнения, а электрофизиологические характеристики клеток харовых водорослей могут успешно применяться для фундаментальных исследований состояния клеток водорослей и проницаемости плазмалеммы при изменении физико-химических условий среды.
Благодарности. Авторы выражают благодарность профессору Стому Д.И. за участие в обсуждении результатов, а также Элиас В.В. за помощь при выполнении работы.
Cписок литературы 1. Бейм А.М. Экспериментальное обоснование допустимого содержания химических компонентов в очищенных сточных водах Байкальского целлюлозо-бумажного комбината // Охрана природы от загрязнений промышленными выбросами предприятий целлюлозо-бумажной промышленности. – Л.: Гидрометеоиздат, 1983. – С. 6–22. 2. Бейм А.М., Грошева Е.И. 30 лет на Байкале. Оценка влияния на окружающую природную среду 30-летней деятельности Байкальского ЦБК. – Байкальск: Ин-т Экологической токсикологии, 1996. – 103 с. 3. Камия Н. Движение цитоплазмы. – М.: Мир, 1962. – 306 с. 4. Кожова О.М., Бейм А.М. Экологический мониторинг Байкала. – М.: Экология, 1993. – 352 с. 5. Первис Р. Микроэлектродные методы внутриклеточной регистрации и ионофореза. – М.: Мир, 1983. – 208 с. 6. Плеханов С.Е. Первичные функциональные реакции пресноводных зеленых водорослей на химическое загрязнение: Автореф. дис. докт. биол. наук. – М, 1999. – 50 с. 7. Рыбальский К.Г., Малярова М.А., Горбатовский В.В., Рыбальская В.Ф., Красюкова Т.В., Левин С.В. Экология и безопасность. М.: ВНИИПИ, 1993. – 320 с. 8. Стом Д.И. О токсичности и детоксикации фенольных соединений гидрофитами // Исследование природных ресурсов озера Байкал и ангарских водохранилищ. – Иркутск: ИГУ, 1984. – С. 142–150. 9. Юрин В.М., Соколик А.И., Кудряшов А.П. Регуляция ионного транспорта через мембраны растительных клеток. – Минск: Наука и техника, 1991. – 271 с. Статья поступила в редакцию 30.12.2017
Evaluation of waste water’s phenols toxicity using algae Characeae Sergey E. Plekhanov, L’ubov B. Bratkovskaya Lomonosov Moscow State University (Moscow, Russia) Initial effects of phenols on the cells Nitella determined of its interaction with cell wall, membrane what further induce the worsening of protoplasm moving which reflect the physiological state of cell. At low concentrations phenols induced the reversible effects on the protoplasm moving speed, but high concentrations leads to the suppression of protoplasm moving speed, decreasing the membrane potential and electrical resistance, and after that – to cell’s dead. Key words: phenols; фенолы; algae Nitella; protoplasm moving; electrophysiological properties.
Об авторах Плеханов Сергей Елисеевич – Plekhanov Sergey E. доктор биологических наук plekhanovse@yandex.ru Братковская Любовь Борисовна – Bratkovskaya L’ubov B. кандидат биологических наук plekhanovse@yandex.ru Корреспондентский адрес: Россия, 119991, Москва, Ленинские горы, Московский Государственный Университет им.М.В.Ломоносова, д. 1, стр. 12, Биологический ф-т, каф. гидробиологии
ССЫЛКА НА СТАТЬЮ: Плеханов С.Е., Братковская Л.Б. Харовые водоросли в оценке токсичности фенолов сточных вод // Вопросы современной альгологии. 2018. № 1 (16). URL: http://algology.ru/1264 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||