|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VI Сабининские чтения 1 ноября - 15 декабря 2017 г. Оценка функционального состояния морского фитопланктона по флуоресцентным показателям и соотношению концентраций феофитина и хлорофилла а
Мошаров С.А.1,2, Сергеева В.М.1 Sergey A. Mosharov, Valentina М. Sergeeva
1Институт океанологии им. П.П. Ширшова РАН – ИОРАН (Москва, Россия) УДК 574.583:581.132
В статье рассматриваются относительная переменная флуоресценция хлорофилла a, концентрация хлорофилла а и доля феофитина в сумме хлорофилл а и феофитин как индикаторы функциональной активности морского фитопланктона, определяющей продуктивный потенциал водорослей в экосистеме Карского моря в конце вегетационного сезона. Ключевые слова: флуоресценция хлорофилла; переменная флуоресценция; доля феофитина; фитопланктон.
Введение В мировой практике экологических исследований флуоресцентный метод широко используется последние 30 лет. Он применяется для оценки физиологического состояния фитопланктона и его фотосинтетической способности, включая соотношение между фиксацией углерода и другими процессами в электрон-транспортной цепи (Falkowski, Kiefer, 1985; Kiefer, Chamberlin, 1989; Röttgers, 2007; Erga et al., 2014). Данный метод основан на измерении активной флуоресценции хлорофилла а. Основной определяемый параметр – относительная переменная флуоресценция Fv/Fm – рассматривается как показатель максимальной квантовой эффективности фотосинтеза и часто используется при исследовании функционального состояния и физиологических изменений в фитопланктоне (Garrido et al., 2013; Erga et al., 2014), как индикатор биогенного стресса (Falkowski, Raven, 2007), при оценке фотоадаптации и фотоингибирования (Alderkamp et al., 2012), в токсикологических исследованиях воздействия различных веществ на фотосинтетический аппарат разных видов планктонных водорослей (Matorin et al., 2009). Целью данной работы исследование продукционного потенциала фитопланктона в конце вегетационного периода в Карском море с использованием флуоресцентных характеристик.
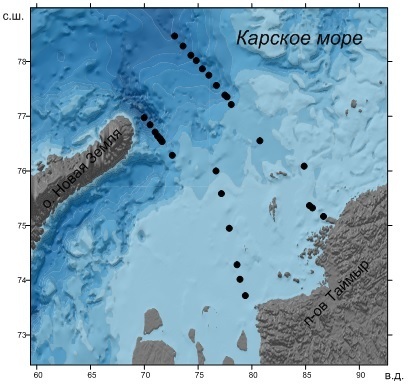
Материалы и методы Материал для исследования был собран в 59-м рейсе НИС «Академик Мстислав Келдыш» с 17 по 29 сентября 2011 г. в Карском море на континентальном шельфе и склоне в районе желоба Св. Анны (рис. 1). Пробы воды были собраны батометрами Нискина комплекса Rossete. Концентрацию хлорофилла a определяли в ацетоновом экстракте флуориметрически (Holm-Hansen, Riemann, 1978) с помощью флуориметра МЕГА-25.
Рис 1. Район исследований и расположение станций Fig 1. Research area and station location
Активную флуоресценцию хлорофилла a определяли с помощью PAM-флуориметра МЕГА-25 (МГУ, Россия). При этом определяли такие параметры, как минимальная и максимальная флуоресценция адаптированных к темноте проб (F0 и Fm), максимальная и равновесная флуоресценции при природном свете (Fm' и Ft). Относительная переменная флуоресценция (Fv/Fm) дает оценку максимальной квантовой эффективности фотосистемы 2 (ФС2) Fv/Fm = (Fm–F0)/Fm. Фотохимическая квантовая эффективность ФС2 при естественном освещении Y рассчитывается как отношение Y = (Fm' – Ft)/Fm' . Относительная скорость нециклического электронного транспорта при данной интенсивности света (rETR) оценивалась по формуле rETR = Y × E × 0,5, где E – освещенность (мкЕ·м-2·с-1), а коэффициент 0,5 устанавливается с учетом того, что для переноса одного электрона через всю цепь электронного транспорта используется энергия двух поглощенных квантов ФАР (один в ФС2, другой в ФС1) (Lippemeier et al., 1999; Schreiber, 2004). Величина rETR позволяет количественно оценить скорость перехода солнечной энергии в химическую энергию клетки, обеспечивающую процессы биосинтеза органического вещества фитопланктоном. Для учета фитопланктона пробы воды, сконцентрированные методом обратной фильтрации и зафиксированные формалином, обрабатывали в камерах Ножотта (объем 0,01 мл) и Наумана (объем 1 мл) под световым микроскопом Leica. Сырую биомассу рассчитывали, исходя из линейных размеров клеток, используя метод подобия геометрическим фигурам. Пересчет сырой биомассы в единицы углерода был выполнен по опубликованным аллометричесим зависимостям (Menden-Deuer et al., 2000). Глубина эвфотического слоя, т.е. глубина проникновения 1% поверхностной освещенности, определялась с использованием датчиков освещенности в диапазоне ФАР (Li-190A и Li-192A, Li-Cor Со).
Результаты и обсуждение Во второй половине сентября 2011 г. в районе исследования глубина эвфотического слоя варьировала в широком диапазоне – от 5 до 30 м. Максимальная квантовая эффективность ФС2 (Fv/Fm), характеризующая потенциальную способность фитопланктона к фотосинтезу, была измерена в пределах верхнего 75 м слоя водной толщи и варьировала от 0,100 до 0,836 отн. ед. со средним значением 0,530±0,152. Вертикальное распределение значений Fv/Fm было неоднородным, и на большинстве станций максимальные значения (выше 0,5) наблюдались в верхнем 30-метровом слое воды при последующем снижении в более глубоких слоях. Таким образом, во второй половине сентября во всей исследованной области Карского моря – и на континентальном шельфе, и в желобе Св. Анны – величины Fv/Fm характеризовали высокий потенциал фотосинтетической активности фитопланктона во всем эвфотическом слое (т.е. в верхних 30 м водного столба). Концентрация хлорофилла a в пределах верхнего 75 м слоя варьировала от 0,017 до 1,493 мг/л со средним значением 0,405±0,321 мг/л. При этом наибольшие значения (до 1,493 мг/л) были сосредоточены в верхнем 18-метровом слое. Глубже, в слое 20–30 м, концентрации хлорофилла a не превышали 0,5 мг/л, варьируя в широком диапазоне с минимальными значениями 0,030 мг/л. Доля феофитина (неактивной формы хлорофилла a) в общей сумме хлорофилла a и феофитина в период исследований в эвфотическом слое варьировала от 5% до 56% при среднем значении 31±8%. В водной толще ниже эвфотического слоя доля феофитина варьировала от 25% до 58% при среднем значении 49±16%.
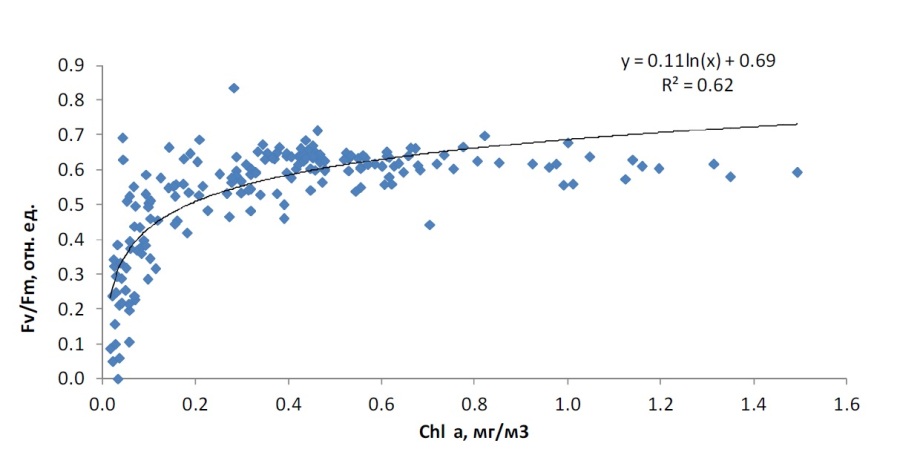
Сравнительный анализ вариабельности параметров состояния фитопланктона показал следующее. Величины относительной переменной флуоресценции Fv/Fm были связаны с концентрацией хлорофилла a логарифмической функцией (рис. 2). При низких концентрациях хлорофилла a (до 0,2 мг/м3) зависимость была очень сильной – небольшим изменениям концентрации хлорофилла a соответствовали существенные изменения значений Fv/Fm. Максимальная величина Fv/Fm в большинстве случаев наблюдалась там, где концентрация хлорофилла a была выше 0,3 мг/м3.
Рис. 2. Зависимость Fv/Fm от концентрации хлорофилла a в водной толще Fig. 2. Relationship between Fv/Fm and chlorophyll a concentration
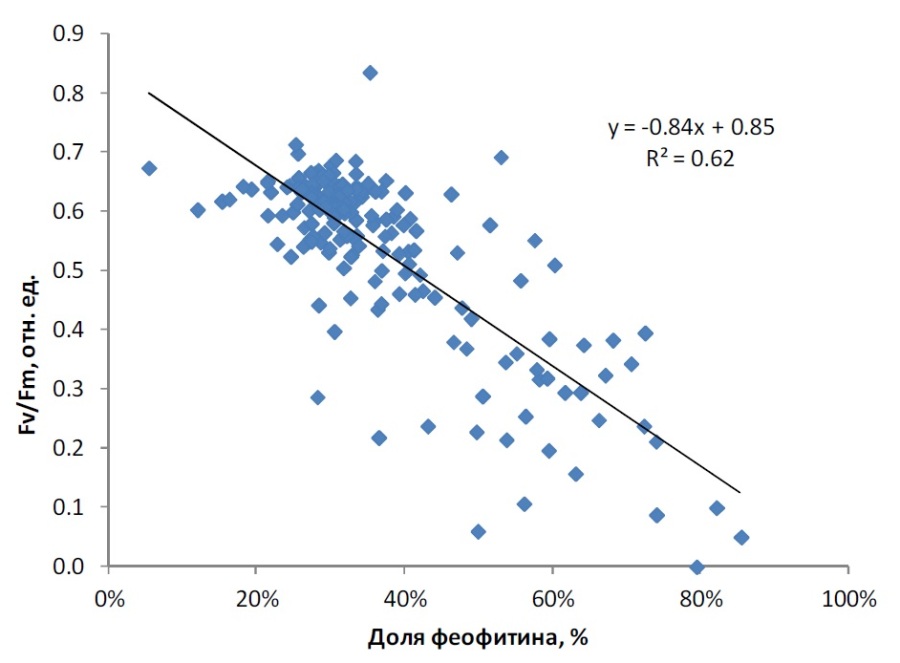
Между значениями Fv/Fm и долей феофитина в общей сумме хлорофилла a и феофитина наблюдалась обратная зависимость (рис. 3). Основная часть фитопланктона характеризовалась высокими величинами Fv/Fm (0,4–0,7), при этом доля феофитина варьировала от 10% до 40%. Увеличение доли феофитина более 40% соответствовало значительному снижению активности хлорофилла a и, соответственно, снижению максимальной квантовой эффективности ФС2 фитопланктона (Fv/Fm). Низкое и неизменное при инкубировании в темноте значение относительной переменной флуоресценции Fv/Fm ниже 0,3 соответствует глубоким необратимым процессам повреждения фитопланктона и является показателем деградации водного фитоценоза (Осипов, 2006). В наших исследованиях при низком диапазоне значений относительной переменной флуоресценции Fv/Fm доля феофитина в сумме пигментов составляла 65–86%.
Рис. 3. Зависимость Fv/Fm от величины доли феофитина Fig. 3. Relationship between Fv/Fm and share of pheophytin
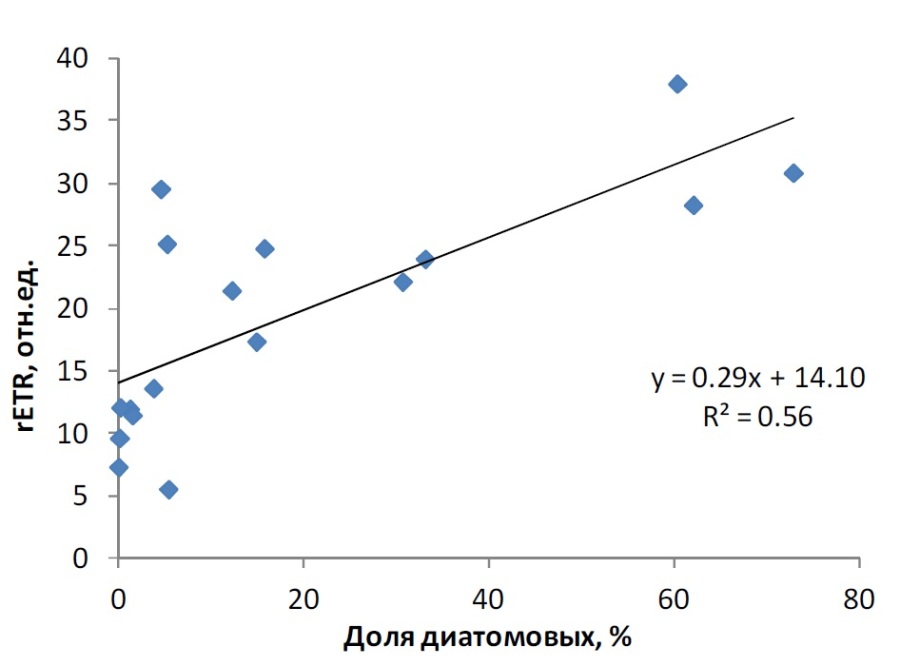
Увеличение доли феофитина в популяциях фитопланктона объясняется феофитинизацией, протекающей при низкой освещенности, и накоплением в нем детрита (Берсенева, Крупаткина, 1990; Yentsch, 1965). Детрит представляет собой мертвое органическое вещество, включающее, в том числе, и отмершие клетки фитопланктона. Таким образом, накопление детрита отражает снижение доли активных клеток микроводорослей в фитопланктонном сообществе в силу разных причин – пищевой активности зоопланктона, завершения фазы активного роста отдельных групп водорослей, резких изменений абиотических условий. Существует мнение, что хлорофилл превращается в феофитин в культуре при выдерживании в темноте (Раймонт, 1983). Феофитинизация, связанная с низкой освещенностью или темнотой, наблюдается при опускании клеток фитопланктона ниже эвфотической зоны и нахождении там определенное время (более 70 часов) (Yentsch, 1965). Процесс феофитинизации может быть обратимым, и происходит восстановление содержания хлорофилла а в клетках с разрушенным в темноте пигментом, когда клетки снова подвергаются действию света. Это может быть связано с фотоокислением феопигментов и перемещением атома магния в центр порфиринового кольца (Раймонт, 1983). В период наших исследований в конце вегетационного сезона высокая доля феофитина, более 40%, и, соответственно, низкие значения Fv/Fm (менее 0,4) наблюдались в основном на горизонтах ниже эвфотического слоя, что может отражать как накопление в этих горизонтах оседающих погибших клеток фитопланктона (в виде детрита), так и процесс феофитинизации живых клеток при недостатке света. В пяти случаях аналогичная картина наблюдалась и в пределах эвфотического слоя, что может свидетельствовать о снижении активности фитопланктона именно за счет деструктивных процессов в клетках. Таким образом, можно было выделить 3 диапазона феофитинизации фитопланктона, соответствующих разному физиологическому состоянию водорослей по относительной переменной флуоресценции. Содержание феофитина в сумме пигментов до 40% соответствовало активному состоянию клеток планктонных микроводорослей, свидетельствующему о высоком продукционном потенциале фитопланктонного сообщества. В диапазоне 40–65% феофитина в сумме пигментов – фитопланктон находится в угнетенном состоянии с пониженной физиологической активностью и низким продукционным потенциалом. При доле феофитина более 65% клетки водорослей не обладают нужным для фотосинтеза потенциалом и отмирают. Ранее было показано, что продукционная активность фитопланктона обратно коррелирует с долей феофитина (Foy, 1987; Мошаров и др., 2016). В предыдущей работе (Мошаров и др., 2016) было показано, что во второй половине сентября в Карском море наиболее оптимальные условия для первичной продукции были в поверхностном слое 0–3 м. Доля феофитина здесь варьировала от 19 до 42%, т.е. сообщество фитопланктона находилось в физиологически активном состоянии. Функциональная активность фитопланктона, отражающаяся на скорости первичной продукции на данной акватории, определяется доминирующими группами микроводорослей и их реакцией на условия среды. Для выявления группы, определяющей продуктивный потенциал фитопланктона, в сообществе было выделено пять групп водорослей: автотрофные динофлагелляты, «активные» диатомовые, споры диатомовых, автотрофные жгутиковые, гетеротрофы. Корреляционный анализ продукционных характеристик и состава сообщества планктонных микроводорослей на поверхности выявил тесную взаимосвязь между долей диатомовых в общей биомассе фитопланктона с относительной скоростью нециклического электронного транспорта в ФС2 (rETR), характеризующую скорость перехода солнечной энергии в химическую энергию клетки (рис. 4). С другими группами такой взаимосвязи выявлено не было.
Рис. 4. Изменчивость rETR в зависимости от доли диатомовых в общей биомассе (по углероду) фитопланктона Fig. 4. Variability of rETR in relation to share of diatoms in total carbon biomass of phytoplankton
Таким образом, в конце вегетационного периода в Карском море при низком уровне освещенности именно диатомовое сообщество реализует продукционный потенциал.
Выводы Относительная переменная флуоресценция хлорофилла a Fv/Fm, характеризующая потенциальную способность фитопланктона к фотосинтезу, и доля феофитина в общей сумме хлорофилла а и феофитина, характеризующая степень активности и ненарушенности хлорофилла, достаточно хорошо отражают функциональное состояние фитопланктона и его продукционную способность. При этом совместное использование двух этих показателей позволяет оценивать вклад темновой феофитинизации и детритообразования в снижение доли активного хлорофилла. По результатам сравнительного анализа величин Fv/Fm и доли феофитина было предложено выделить три диапазона значений доли феофитина, характеризующие разное физиологическое состояние и потенциальную продукционную способность фитопланктона. Доля феофитина менее 40% соответствовало активному состоянию фитопланктона с высоким продукционным потенциалом. В диапазоне 40–65% феофитина в сумме пигментов – фитопланктон находится в угнетенном состоянии с пониженной физиологической активностью и низким продукционным потенциалом. При доле феофитина более 65% клетки водорослей не обладают нужным для фотосинтеза потенциалом и отмирают. В конце вегетационного сезона в Карском море при низкой освещенности изменчивость продукционной активности фитопланктона была связана с изменением доли диатомовых в общей биомассе фитопланктона.
Работа выполнена в рамках госзадания ФАНО России № 0149-2018-0033 (анализ активной флуоресценции хлорофилла и оценка продукционного потенциала) и при поддержке гранта РФФИ № 16-35-60068 мол_а_дк (анализ содержания хлорофилла «а» и феофитина).
Список литературы 1. Берсенева Г.П., Крупаткина Д.К. Особенности распределения пигментов фитопланктона в восточной части Черного моря в ранний летний период // Экология моря. 1990. Вып.35. С. 1–6. 2. Мошаров С.А., Демидов А.Б., Симакова У.В. Особенности процессов первичного продуцирования в Карском море в конце вегетационного периода // Океанология. 2016. Т.56, №1. С. 90–100. 3. Осипов В.А. Зависимость флуоресцентных параметров микроводорослей от факторов среды, включая антропогенные загрязнения: Автореф. дис. канд. биол. наук. – Москва, 2006. – 25 с. 4. Раймонт Дж. Планктон и продуктивность океана: Том 1. Фитопланктон. – М.: Легкая и пищевая пром-ть, 1983. – 568 с. 5. Alderkamp A.-C., Kulk G., Buma A.G.J., Visser R.J.W., Van Dijken G.J., Mills M.M., Arrigo K.R. The effect of iron limitation on the photophysiology of Phaeocystis antarctica (Prymnesiophyceae) and Fragilariopsis cylindrus (Bacillariophyceae) under dynamic light // J. Phycol. 2012. V.48. P. 45–59. 6. Erga S.R., Ssebiyonga N., Hamre B., Frette Q., Hovland E., Hancke K., Drinkwater K., Rey F. Environmental control of phytoplankton distribution and photosynthetic performance at the Jan Mayen Front in the Norwegian Sea // J. of Marine Systems. 2014. V.130. P. 193–205. 7. Falkowski P.G., Kiefer D.A. Chlorophyll a fluorescence in phytoplankton: relationship to photosynthesis and biomass // J. Plankton Res. 1985. V. 7, №5. P. 715–731. 8. Falkowski P.G., Raven J.A. Aquatic Photosynthesis, 2nd edn. – Princeton, NJ: Princeton University Press, 2007. – 476 p. 9. Foy R.H. A comparison of chlorophyll a and carotenoid concentrations as indicators of algal volume // Freshwater Biol. 1987. 17, №2. P. 237–250. 10. Garrido M., Cecchi P., Vaquer A., Pasqualini V. Effects of sample conservation on assessment of the photosynthetic efficiency of phytoplankton using PAM fluorometry // Deep-Sea Res. I. 2013. V.71. P. 38–48. 11. Holm-Hansen O., Riemann B. Chlorophyll a determination: improvements in methodology // Oikos. 1978. V.30. P. 438–447. 12. Kiefer D.A., Chamberlin W.S. Natural fluorescence of chlorophyll a: Relationship to photosynthesis and chlorophyll concentration in the western South Pacific gyre // Limnol. Oceanogr. 1989. V.34, №5. P. 868–881. 13. Lippemeier S., Harting P., Colijn F. Direct Impact of Silicate on the Photosynthetic Performance of the Diatom Thalassiosira weissflogii Assessed by On- and Off-Line PAM Fluorescence Measurements // J. Plankton Res. 1999. V.21. P. 269–283. 14. Matorin D.N., Osipov V.A., Seifullina N.Kh., Venediktov P.S., Rubin A.B. Increased toxic effect of methylmercury on Chlorella vulgaris under high light and cold stress conditions // Microbiology. 2009. V.78(3). P. 321–327. 15. Menden-Deuer S., Lessard E.J. Carbon to volume relationships for dinoflagellates, diatoms, and other protist plankton // Limnology Oceanography 2000. V.45. №3. P. 569–579. 16. Röttgers R. Comparison of different variable chlorophyll a fluorescence techniques to determine photosynthetic parameters of natural phytoplankton // Deep-Sea Research I. 2007. V.54. P. 437–451. 17. Schreiber U. Pulse amplitude (PAM) fluorometry and saturation pulse method: an overview // Papageorgiou G., Govindjee G. (Eds.) Chlorophyll a fluorescence: a signature of photosynthesis. Advances in photosynthesis and respiration series. – Dordrecht: Kluwer Academic Publishers, 2004. – P. 270–319. 18. Yentsch C.S. Distribution of chlorophyll and phaeophytin in the open ocean // Deep-Sea Res. 1965. V.12. P. 653–666. Статья поступила в редакцию 15.12.2017
Estimate of the marine phytoplankton state by fluorescence parameters Sergey A. Mosharov1,2, Valentina M. Sergeeva1 1Shirshov Institute of Oceanology, Russian Academy of Sciences (Russia, Moscow) Relative variable fluorescence of chlorophyll a, chlorophyll a concentration and share of pheophytin in sum of chlorophyll a and pheophytin regard as indicators of the marine phytoplankton functional activity, which determine primary productive capability in the Kara Sea ecosystem at the end of the vegetation season. Key words: chlorophyll fluorescence; variable fluorescence; share of pheophytin; phytoplankton.
Об авторах Мошаров Сергей Александрович – Mosharov Sergey A. кандидат биологических наук sampost@list.ru Сергеева Валентина Михайловна - Sergeeva Valentina M. кандидат биологических наук vsergeeva@gmail.com
Корреспондентский адрес: Россия, 117997, Москва, Нахимовский проспект, д.36, Институт океанологии им. П.П.Ширшова РАН; телефон (499)124-59-96
ССЫЛКА НА СТАТЬЮ: Мошаров С.А., Сергеева В.М. Оценка функционального состояния морского фитопланктона по флуоресцентным показателям и соотношению концентраций феофитина и хлорофилла а // Вопросы современной альгологии. 2018. № 1 (16). URL: http://algology.ru/1257 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ 
|
|||
|
| ||