|
|
|
|
по Материалам Международной конференции «Экологическая физиология водных фототрофов: распространение, запасы, химический состав и использование» VI Сабининские чтения 1 ноября - 15 декабря 2017 г. Новые для почвенной альгофлоры России виды зеленых водорослей Bracteacoccus bullatus и B. occidentalis (Sphaeropleales, Chlorophyta)
Темралеева А.Д. Anna D. Temraleeva
Институт физико-химических и биологических проблем почвоведения РАН (Пущино, Россия) УДК 582.263
Впервые для почвенной альгофлоры России приводятся зеленые водоросли Bracteacoccus bullatus и B. occidentalis. Данные находки были обнаружены в каштановой почве Волгоградской области и подтверждены с помощью 18S рРНК- и ITS2-анализа. Шесть изученных штаммов депонированы в Альгологическую коллекцию ACSSI (http://acssi.org). Ключевые слова: зеленые водоросли; морфология;18S рРНК ITS2; каштановая почва; ACSSI.
Введение Род Bracteacoccus был описан в 1923 году как шаровидная многоядерная водоросль с множественными дисковидными хлоропластами, способная размножаться с помощью аплано- и зооспор (Tereg, 1923). Затем диагноз был уточнен: зооспоры голые с двумя жгутиками слегка неравной длины (Starr, 1955). На основе данной характеристики описаны 17 видов: B. aerius Bischoff et Bold, типовой вид – B. aggregatus Tereg, B. anomalus (James) Starr, B. cinnabarinus (Kol et Chodat) Starr, B. cohaerens Bischoff et Bold, B. engadinensis (Kol et Chodat) Starr, B. gametifer (Chodat) Starr, B. gerneckii (Wille) Starr, B. giganteus Bischoff et Bold, B. grandis Bischoff et Bold, B. helveticus (Kol et Chodat) Starr, B. irregularis (Petersen) Starr, B. medionucleatus Bischoff et Bold, B. minor (Schmidle ex Chodat) Petrová, B. minutus Schwarz, B. pseudominor Bischoff et Bold и B. terrestris (Kol et Chodat) Starr. С развитием методов молекулярной филогенетики был проведен ряд ревизий рода (Fuciková et al., 2011, 2012; Fuciková, Lewis, 2012), результатом которых стала синонимизация B. cinnabarinus, B. minutus и Chromochloris zofingiensis (Dönz) Fucíková et Lewis; B. aggregatus и B. cohaerens; B. terrestris, B. engadinensis и Pseudomuriella engadinensis (Kol et Chodat) Fuciková, Rada et Lewis; B. irregularis и Myrmecia irregularis (Petersen) Ettl et Gärtner. Также были открыты новые виды: B. bohemiensis Fuciková, Flechtner et Lewis, B. bullatus Fuciková, Flechtner et Lewis, B. deserticola Fuciková, Flechtner et Lewis, B. glacialis Fuciková, Flechtner et Lewis, B. occidentalis Fuciková, Flechtner et Lewis, B. polaris Fuciková, Flechtner et Lewis, B. ruber Novis et Visnovsky и B. xerophilus Fuciková, Flechtner et Lewis. Различные виды рода Bracteacoccus повсеместно встречаются в почвах России (Алексахина, Штина, 1984; Андреева, 1998; Штина и др., 1998; Кузяхметов, 2006; Кондакова, Домрачева, 2007; Дубовик и др., 2008; Хайбуллина и др., 2011; Бакиева и др., 2012; Новаковская, Патова, 2013 и др.). Однако находки B. bullatus и B. occidentallis, подтвержденные с помощью 18S рРНК- и ITS2-анализов, приводятся впервые.
Материалы и методы Изоляция и культивирование штаммов водорослей. Объектами данного исследования стали шесть диких штаммов зеленых водорослей рода Bracteacoccus, депонированные в Альгологическую коллекцию ACSSI (http://acssi.org): B. bullatus ACSSI 095, 097, 108, 134 и B. occidentalis ACSSI 099 и 221. Штаммы были получены из почвенно-альгологических проб, отобранных из горизонта A1 каштановой почвы Волгоградской области (47°53'21" с.ш., 44°0'50" в.д.), при нанесении почвенной суспензии на среду BG11 с азотом (1% агар, pH=7,0) и дальнейшем многократном пересеве отдельных колоний. Все полученные изоляты культивировали в климатостате в стандартных условиях (температура +23–25ºС, свет 60–75 μмоль фотонов • м-2 • с-1, фотопериод 12 ч.). Микроскопия. Изучение морфологии и жизненных циклов штаммов проводили методами световой микроскопии (светлое поле и интерференционный контраст) с помощью микроскопов Leica DM750 «Leica microsystems» и Carl Zeiss Axio Scope A1 «Carl Zeiss Microscopy GmbH» (Германия) в ЦКП ИФХиБПП РАН. Результаты наблюдений документировали рабочими рисунками и фотографиями, снятыми с помощью цветных цифровых камер «Видеозавр» (Россия) и Carl Zeiss MRc 5 (Германия). Для таксономической идентификации проводили несколько прижизненных цитохимических реакций: на крахмал – раствором Люголя, на слизь – 1%-ным раствором туши. Сроки наблюдения за штаммами составляли от 12 часов до 6 месяцев. Выделение, амплификация, очистка и секвенирование ДНК. ДНК выделяли из биомассы зеленых водорослей с помощью набора DNeasy Plant Mini Kit «Qiagen» (США), следуя протоколу производителя. При амплификации использовали готовую смесь для ПЦР Screen Mix-HS «Евроген» (Россия). Для амплификации гена 18S рРНК были выбраны праймеры и условия из статьи Katana с соавт. (2001), для ITS2 использовали универсальные праймеры из статьи White с соавт. (1990) с оптимизированными условиями ПЦР: 95ºC – 3 мин.; 95ºC – 30 сек., 57,6ºC – 30 сек., 72ºC – 1 мин., 35 циклов; 72ºC – 10 мин. Детекцию целевых ПЦР-продуктов проводили электрофоретически в 1%-ном агарозном геле. Для дальнейшей очистки ампликонов из геля применяли набор Cleanup Mini «Евроген» (Россия). Секвенирование нуклеотидных последовательностей осуществляли на базе ЗАО «Синтол» (Россия). Молекулярно-филогенетический анализ. Для молекулярно-филогенетического анализа была составлена выборка из 48 последовательностей гена 18S рРНК и ITS2 штаммов зеленых водорослей, относящихся к роду Bracteacoccus, которая включала собственные данные и данные GenBank. Объем рода сформирован на основе предыдущих работ Fuciková с соавт. (2011, 2012) и Fuciková, Lewis (2012). В выборку вошли штаммы, которые имели обе последовательности (18S рРНК и ITS2). Выравнивание нуклеотидных последовательностей выполняли в программе BioEdit по алгоритму ClustalW. Общая длина анализируемых последовательностей для гена 18S рРНК составила 1757 п.н., для ITS2 – 339 п.н. При наличии интронов в гене 18S рРНК они были удалены из выравнивания (последовательности MG582209, MG523291, JF717412, JF717410). Для выбора модели нуклеотидных замен использовали программу jModelTest. Для обоих маркеров оптимальной стала модель GTR+G. Реконструкцию филогенетических взаимосвязей осуществляли методом максимального правдоподобия (ML) в программе PhyML. В качестве внешней группы выбрали представителя другого рода – Neochloris aquatica UTEX B 138. Статистическая поддержка топологии деревьев была оценена с помощью бутстреп-анализа (1000 повторностей) и указана в узлах ветвей. Вычисление генетических дистанций проводили в программе MEGA 5.0. Для анализа вторичной структуры ITS2 была выполнена аннотация спейсера в ITS2-DataBase (http://its2.bioapps.biozentrum.uni-wuerzburg.de), его фолдинг с помощью веб-сервера mfold (http://unafold.rna.albany.edu), сравнение вторичной структуры между штаммами, поиск консервативных мотивов и компенсаторных замен осуществляли в программе 4SALE. При оценке правильности фолдинга ITS2 мы ориентировались на работы Fucikova с соавт. (2012) и Caisová с соавт. (2013).
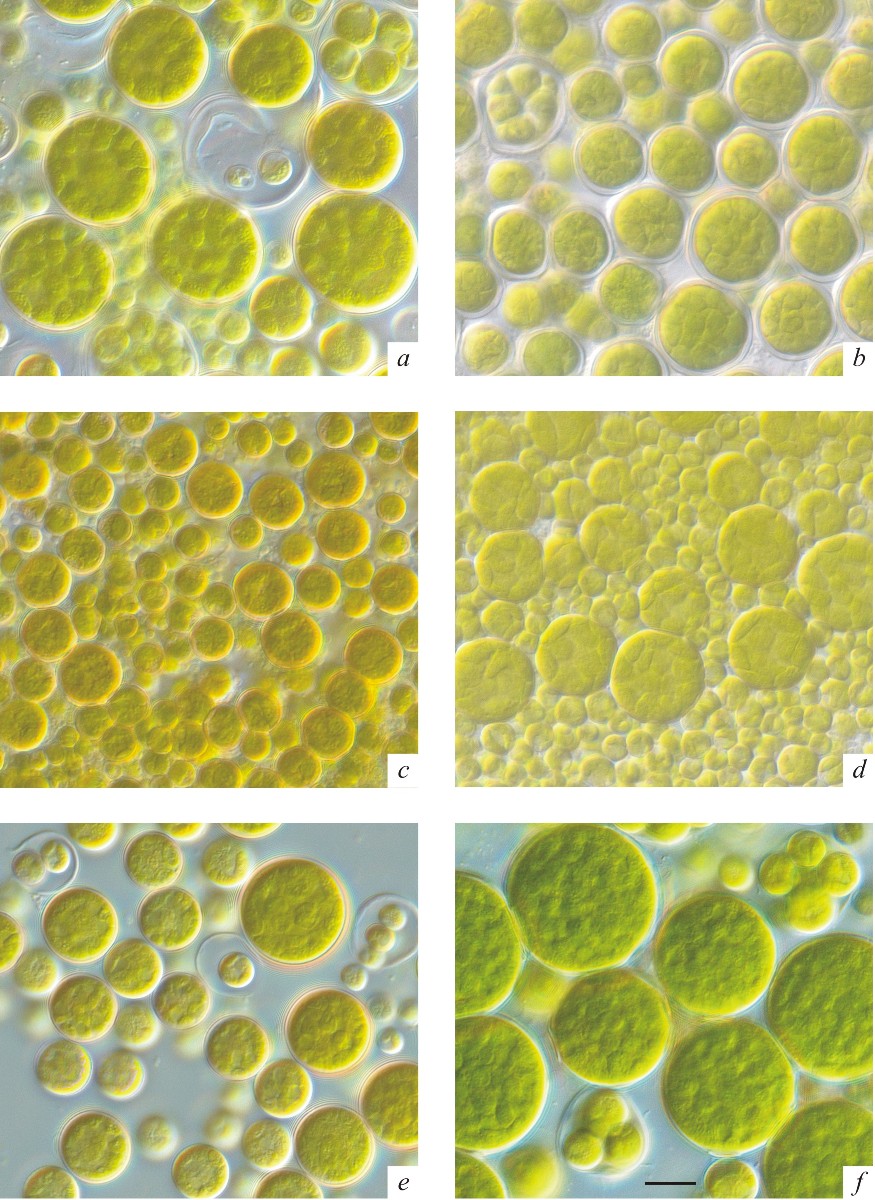
Результаты и обсуждение Все шесть изученных штаммов ACSSI 095, 097, 099, 108, 134 и 221 имели характерные для представителей рода Bracteacoccus морфологические признаки: преимущественно шаровидную форму клеток, многочисленные хлоропласты без пиреноидов, многоядерность, способность к вторичному каротиногенезу, размножение с помощью апланоспор и голых зооспор со жгутиками слегка неравной длины (рис. 1).
Рис. 1. Фотографии штаммов B. bullatus ACSSI 095 (a), 097 (b), 108 (c), 134 (d) и B. occidentalis ACSSI 099 (e), 221 (f), изолированных из каштановой почвы Волгоградской области. Шкала 10 мкм Fig. 1. Micrographs of strains B. bullatus ACSSI 095 (a), 097 (b), 108 (c), 134 (d) and B. occidentalis ACSSI 099 (e), 221 (f) isolated from the chestnut soil of the Volgograd region. Scale 10 μm
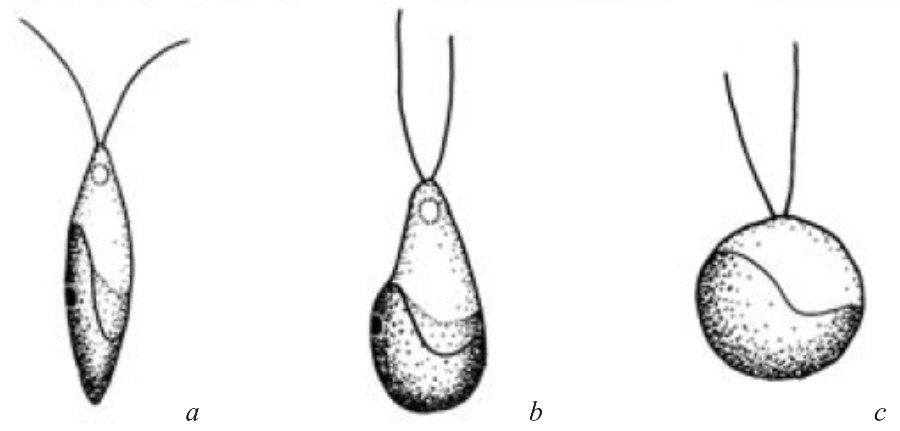
В таблице 1 объединены важные морфологические характеристики описанных видов рода Bracteacoccus (Андреева, 1998; Fuciková, Lewis, 2012; Novis, Visnovsky, 2012). Однако размер вегетативных клеток и толщина слизистой оболочки могут широко варьировать и зависеть от культуральных условий. Форма голых, метаболичных зооспор сильно изменяется после освобождения из оболочки зооспорангия до полной остановки зооспор. У одного и того же штамма она может быть описана как веретеновидная, грушевидная или шаровидная в зависимости от времени просмотра (рис. 2). ТАБЛИЦА 1 (открывается при нажатии) Таблица 1. Морфологическая характеристика видов рода Bracteacoccus. ________________________________________________________________
Рис. 2. Изменение формы голых зооспор B. aggregatus: (a) веретеновидная форма сразу после освобождения из оболочки зооспорангия, (b) грушевидная форма спустя минуту после освобождения, (c) шаровидная форма перед потерей жгутиков (Fučíková et al., 2012) Fig. 2. Form variation of naked zoospores B. aggregatus: (a) the spindle shape of freshly released zoospore, (b) pear-shaped zoospore in minutes after release, (c) spherical shape before losing flagella (Fučíková et al., 2012)
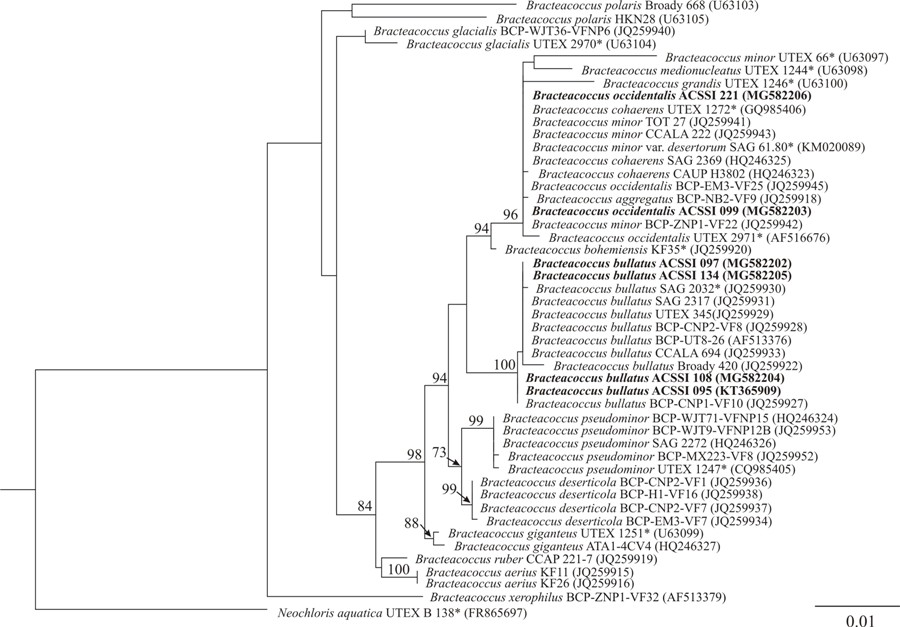
Таким образом, точная идентификация штаммов возможна исключительно на основе молекулярно-генетического анализа. По данным 18S рРНК анализа все шесть штаммов принадлежали роду Bracteacoccus (рис. 3).
Рис. 3. Укорененное филогенетическое дерево зеленых водорослей рода Bracteacoccus, построенное методом максимального правдоподобия (ML), на основе последовательностей гена 18S рРНК Примечание. В качестве статистической поддержки узлов дерева указаны бутстреп-значения ML; значения < 70% не показаны. Модель нуклеотидных замен: GTR+G. Жирным шрифтом выделены штаммы ACSSI, * отмечены аутентичные штаммы. Fig. 3. The rooted phylogenetic tree of green microalgal genus Bracteacoccus constructed by maximal likelihood method (ML) for 18S rRNA gene sequence data Note. Node support of the tree is given as ML bootstrap values; values < 70% are not shown. The model of nucleotide changes is GTR+G was used. ACSSI strains are marked in bold, authentic strains are marked by asterisk.
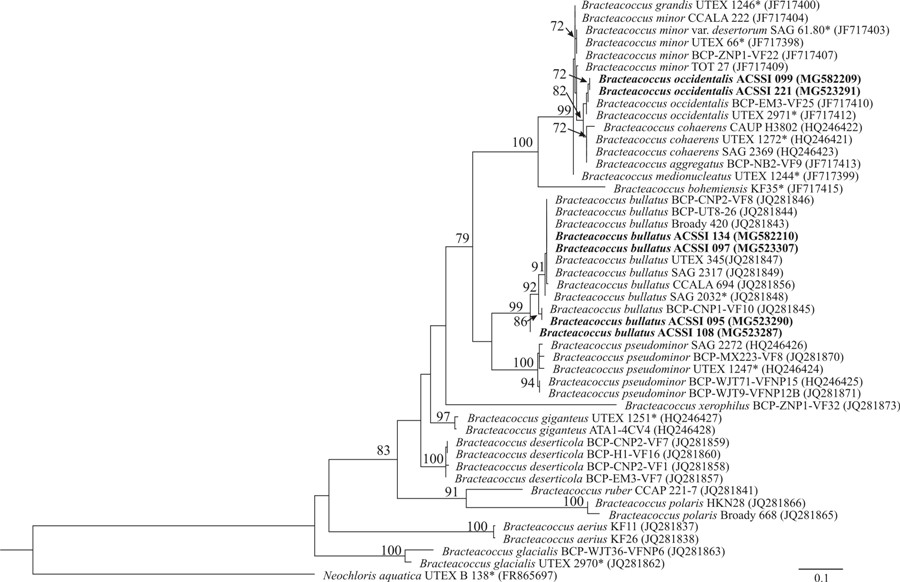
Штаммы ACSSI 095, 097, 108 и 134 со 100%-ной статистической поддержкой вошли в кладу «B. bullatus». Внутривидовые генетические дистанции составили от 0 до 0,1%. Штаммы ACSSI 099 и 221 с 96%-ной статистической поддержкой вошли в кладу, объединяющую виды B. occidentalis, B. cohaerens, B. aggregatus, B. minor, B. grandis, B. medionucleatus. В работе Fučíková с соавт. (2012) B. cohaerens был перенесен в вид B. aggregatus, а B. grandis, B. medionucleatus и B. minor var. desertorum – в вид B. minor. Таким образом, близкородственными являлись виды B. occidentalis, B. aggregatus и B. minor, генетические различия между которыми варьировали от 0 до 0,9%, что показывает необходимость использования более вариабельного молекулярного маркера при разграничении видов. Несмотря на незначительные генетические различия между тремя видами, только у B. occidentalis имеется интрон в гене 18S рРНК. По данным множественного выравнивания у штаммов ACSSI 099 и 221 также был обнаружен интрон длиной 361 п.н., что позволило их отнести к виду B. occidentalis. Внутривидовых различий в интроне найдено не было. Для уточнения положения штаммов была использована первичная структура вариабельного спейсера ITS2, т.к. он быстро эволюционирует и может разделять близкородственные группы организмов (Coleman, 2003). Топология 18S рРНК- и ITS2-деревьев в целом совпадают (рис. 4). С 99%-ной статистической поддержкой штаммы ACSSI 095, 097, 108 и 134 вошли в кладу «B. bullatus». Внутривидовые генетические дистанции составили от 0 до 3,2%. Штаммы ACSSI 099 и 221 с 99%-ной статистической поддержкой вошли в кладу, объединяющую виды B. aggregatus, B. minor и B. occidentalis. Внутривидовые генетические дистанции составляли 0–1,6, 0–1,1 и 0–0,5%, соответственно. Межвидовые генетические различия варьировали от 1,6 до 3,8%.
Рис. 4. Укорененное филогенетическое дерево зеленых водорослей рода Bracteacoccus, построенное методом максимального правдоподобия (ML), на основе анализа первичной структуры ITS2 Примечание. В качестве статистической поддержки узлов дерева указаны бутстреп-значения ML; значения < 70% не показаны. Модель нуклеотидных замен: GTR+G. Жирным шрифтом выделены штаммы ACSSI, * отмечены аутентичные штаммы. Fig. 4. The rooted phylogenetic tree of green microalgal genus Bracteacoccus constructed by maximal likelihood method (ML) for ITS2 sequence data Note. Node support of the tree is given as ML bootstrap values; values < 70% are not shown. The model of nucleotide changes is GTR+G was used. ACSSI strains are marked in bold, authentic strains are marked by asterisk.
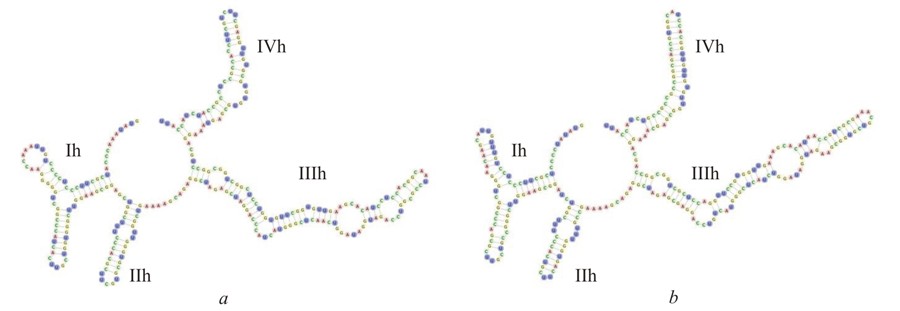
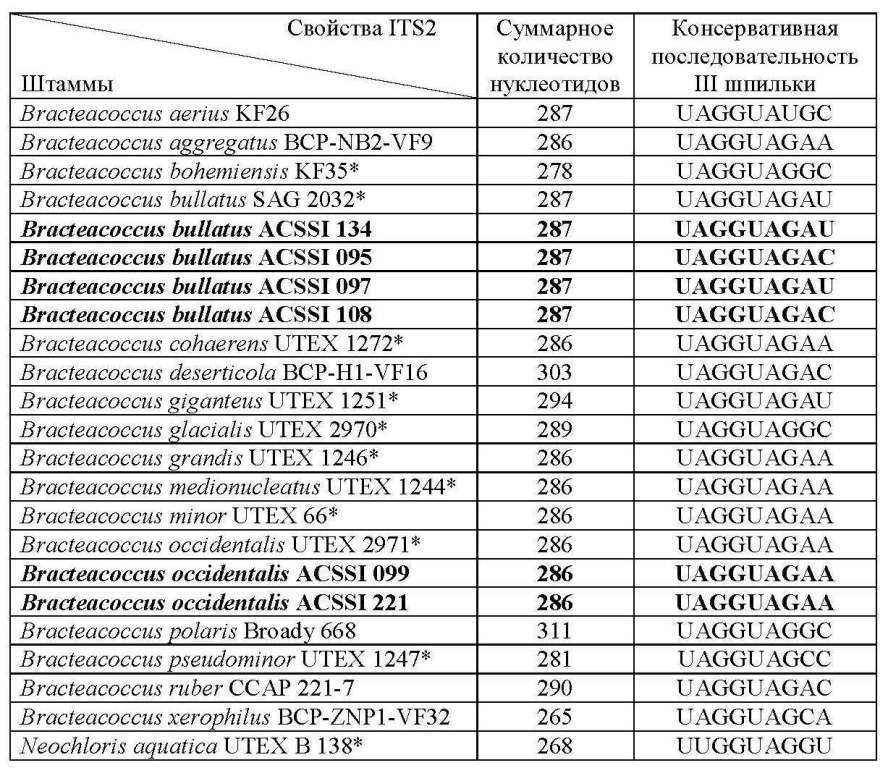
Популярность ITS2-филогении зеленых водорослей определяется также возможностью использования его вторичной структуры в качестве инструмента разделения видов. Данный подход был предложен A. Coleman (2000, 2009), которая показала, что наличие хотя бы 1 компенсаторной замены в консервативных регионах ITS2 (II и III шпилька) у двух водорослей коррелирует с их полной половой несовместимостью. На основе мета-анализа большого числа данных Müller с соавт. (2007) установили, что наличие даже 1 компенсаторной замены в 93% исследованных случаев указывает на принадлежность организмов к разным видам. Напротив, замены в менее консервативных регионах (I и IV шпильки), а также полукомпенсаторные замены в консервативных регионах не были связаны со способностью скрещиваться. Для всех изученных штаммов ACSSI были смоделированы вторичные структуры, в качестве примера приводим штаммы B. bullatus ACSSI 095 и B. occidentalis ACSSI 221 (рис. 5). Их вторичные структуры обладали следующими общими признаками: четыре шпильки, I шпилька разветвлена, II содержит U-U мисматч, III является самой длинной и содержит консервативный мотив UAGGUA, который характерен для представителей всего рода (табл. 2).
Рис. 5. Вторичная структура ITS2 штаммов B. bullatus ACSSI 095 (a) и B. occidentalis ACSSI 221 (b) Fig. 5. The secondary structure of ITS2 of strains B. bullatus ACSSI 095 (a)
При анализе вторичной структуры ITS2 не были обнаружены компенсаторные замены между аутентичными штаммами B. bullatus и B. occidentalis и дикими штаммами из коллекции ACSSI. Длина спейсера составила 287 и 286 п.н., соответственно (табл. 2). У штаммов B. bullatus ACSSI 097 и 134 был обнаружен консервативный мотив в III шпильке (UAGGUAGAU) как и у аутентичного штамма B. bullatus SAG 2032, у двух других штаммов ACSSI 095 и 108 последний нуклеотид в мотиве отличался (U→C). Для штаммов B. occidentalis ACSSI 091 и 221 был характерен мотив UAGGUAGAA, аналогичный мотиву аутентичного штамма B. occidentalis UTEX 2971. Интересен факт, что данный мотив также был найден не только у B. occidentalis, но и у B. minor и B. aggregatus. При сравнении вторичных структур ITS2 обнаружена 1 компенсаторная замена (U-A → C-G) в IV шпильке ITS2 у штаммов B. cohaerens CAUP H3802 и штаммов B. minor UTEX 66, B. grandis UTEX 1246, B. medionucleatus UTEX 1244, B. minor TOT 27, B. minor CCALA 222, B. minor BCP-ZNP1VF22, B. minor var. desertorum SAG 61.80, B. occidentalis ACSSI 099, B. occidentalis ACSSI 221, B. occidentalis UTEX 2971, B. occidentalis BCP-EM3-VF25, которая не учитывается при разграничении видов. По данным 18S рРНК- и ITS2-филогении этой группы близкородственных видов можно предположить, что они являются более эволюционно «молодыми» по сравнению с другими видами рода Bracteacoccus, которые четко разделяются как с помощью дистанционного подхода, так и с помощью анализа вторичной структуры ITS2. Возможно, для надежного разрешения филогении данной группы следует использовать другие вариабельные молекулярные маркеры, например, пластидные гены rbcL и tufA.
Таблица 2. Характеристика вторичной структуры ITS2 видов рода Bracteacoccus. Table 2. ITS2 structures of Bracteacoccus species.
Примечание. Жирным шрифтом выделены штаммы ACSSI, * отмечены аутентичные штаммы. Note. ACSSI strains are marked in bold, authentic strains are marked by asterisk.
Заключение Таким образом, впервые в составе почвенной альгофлоры России были обнаружены два новых вида зеленых водорослей B. bullatus ACSSI 095, 097, 108, 134 и B. occidentalis ACSSI 099, 221 (Sphaeropleales, Chlorophyta). Все шесть штаммов изолированы из каштановой почвы Волгоградской области и по данным морфологии отнесены к роду Bracteacoccus. Последующие 18S рРНК- и ITS2-анализы подтвердили данный диагноз и уточнили его до вида. Вероятно, эти виды достаточно распространены в сухостепных почвах, и отсутствие сведений об их находках связано в первую очередь с использованием традиционных морфологических описаний, а не молекулярно-генетических методов идентификации. Информация обо всех исследованных штаммах представлена на сайте Альгологической коллекции ACSSI (http://acssi.org), а нуклеотидные последовательности депонированы в международную базу данных GenBank (http://www.ncbi.nlm.nih.gov).
Благодарности Автор выражает признательность д.б.н., проф. И.Ю. Костикову за консультации по использованию вторичной структуры ITS2, к.б.н., с.н.с. М.В. Ельцову за участие в экспедиционных работах в Волгоградской области и н.с. С.В. Москаленко за помощь в исследовании.
Работа выполнена при поддержке PФФИ в рамках научного проекта №16-34-60020 мол_а_дк.
Список литературы 1. Алексахина Т.И., Штина Э.А. Почвенные водоросли лесных биогеоценозов. – М.: Наука, 1984. – 149 с. 2. Андреева В.М. Почвенные и аэрофильные зеленые водоросли (Chlorophyta: Tetrasporales, Chlorococcales, Chlorosarcinales). – СПб.: Наука, 1998. – 351 с. 3. Бакиева Г.Р, Хайбуллина Л.С., Гайсина Л.А., Кабиров Р.Р. Эколого-флористический анализ почвенных водорослей и цианобактерий гор рифового происхождения Тра-Тау и Юряк-Тау (Россия) // Почвоведение. 2012. № 9. С. 974–982. 4. Дубовик И.Е., Киреева Н.А., Закирова З.Р., Климина И.П. Макроскопические разрастания водорослей и сопутствующие им микромицеты // Альгология. 2008. Т. 18. № 1. С. 51–57. 5. Кондакова Л.В., Домрачева Л.И. Флора Вятского края. Часть 2. Водоросли (Видовой состав, специфика водных и почвенных биоценозов). – Киров: ОАО «Кировкая областная типография», 2007. – 192 с. 6. Кузяхметов Г.Г. Водоросли зональных почв степи и лесостепи. – Уфа: РИО БашГУ, 2006. – 286 с. 7. Новаковская И.В., Патова Е.Н. Цианопрокариоты и водоросли горно-тундровых почв северной оконечности Полярного Урала // Бюллетень Московского общества испытателей природы. Отдел биологический. 2013. Т.118. №5. С. 57–66. 8. Сайт Альгологической коллекции ИФХиБПП РАН – Algal Collection of Soil Science Institute (ACSSI). URL: http://acssi.org (дата обращения: 06.12.2017). 9. Хайбуллина Л.С., Суханова Н.В., Кабиров Р.Р. Флора и синтаксономия почвенных водорослей и цианобактерий урбанизированных территорий. – Уфа: АН РБ, Гилем, 2011. – 216 с. 10. Штина Э.А., Зенова Г.М., Манучарова Н.А. Альгологический мониторинг почв // Почвоведение. 1998. №12. С. 1449–1461. 11. Caisová L., Marin B., Melkonian M. A Consensus Secondary Structure of ITS2 in the Chlorophyta Identified by Phylogenetic Reconstruction // Protist. 2013. V. 164. P. 482–496. 12. Coleman A.W. The significance of a coincidence between evolutionary landmarks found in mating affinity and a DNA sequence // Protist. 2000. 151(1). P. 1–9. 13. Coleman A.W. ITS2 is a double-edged tool for eukaryote evolutionary comparisons // Trends Genet. 2003. 19(7). P. 370–375. 14. Coleman A.W. Is there a molecular key to the level of “biological species” in eukaryotes? A DNA guide. // Molecular Phylogenetics and Evolution 2009. V.50. P. 197–203. 15. Fucíková C., Lewis L.E. Intersection of Chlorella, Muriella and Bracteacoccus: Resurrecting the genus Chromochloris Kol et Chodat (Chlorophyceae, Chlorophyta) // Fottea. 2012. 12(1). P. 83–93. 16. Fucikova K., Flechtner V.R., Lewis L.A. Revision of the genus Bracteacoccus Tereg (Chlorophyceae, Chlorophyta) based on a phylogenetic approach // Nova Hedwigia. 2012. 96(1–2). P. 15–59. 17. Fuciková K., Rada J.C., Lewis L.A. The tangled taxonomic history of Dictyococcus, Bracteacoccus and Pseudomuriella (Chlorophyceae,Chlorophyta) and their distinction based on a phylogenetic perspective // Phycologia. 2011. 50(4). P. 422–429. 18. Katana A., Kwiatowski J., Spalik K., Zakryś B., Szalacha E., Szymańska H. Phylogenetic position of Koliella (Chlorophyta) as inferred from nuclear and chloroplast small subunit rDNA // J. Phycol. 2001. 37(3). P. 443–451. 19. Müller T., Philippi N., Dandekar T., Schultz J., Wolf M. Distinguishing species // RNA. 2007. 13(9). P. 1469–1472. 20. Novis P.M., Visnovsky G. Novel alpine algae from New Zealand: Chlorophyta // Phytotaxa. 2012. 39. P. 1–30. 21. Starr R.C. A comparative study of Chlorococcum meneghini and other spherical, zoospore-producing genera of the Chlorococcales // Indiana University Publications Science. 1955. 20. P. 1–111. 22. Tereg E. Einige neue Grünalgen // Beihefte zum Botanischen Centralblatt. 1923. 39. P. 179–195. 23. White T.J., Bruns T., Lee S., Taylor J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics // PCR Protocols. – San Diego: Acad. Press, 1990. – Pt.3. – P. 315–322. Статья поступила в редакцию 8.12.2017
Bracteacoccus bullatus и B. occidentalis (Sphaeropleales, Chlorophyta), Anna D. Temraleeva Institute of Physicochemical and Biological Problems in Soil Science of RAS (Pushchino, Russia) For the first time the green algae of Bracteacoccus bullatus and B. occidentalis are given for the Russian soil algoflora. These species were found in the chestnut soil of the Volgograd region and confirmed by means of 18S rRNA and ITS2 analysis. Six studied strains are deposited into the Algological collection ACSSI (http://acssi.org). Key words: green algae; morphology; 18S rRNA; ITS2; chestnut soil; ACSSI.
Об авторе Темралеева Анна Дисенгалиевна - Temraleeva Anna D. кандидат биологических наук
Корреспондентский адрес: Россия, 142290, Московская область, г. Пущино, ул. Институтская, д. 2, ИФХиБПП РАН; телефон: 8(4967)31-81-52.
ССЫЛКА НА СТАТЬЮ: Темралеева А.Д. Новые для почвенной альгофлоры России виды зеленых водорослей Bracteacoccus bullatus и B. occidentalis (Sphaeropleales, Chlorophyta) // Вопросы современной альгологии. 2018. № 1 (16). URL: http://algology.ru/1253 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно. При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||