|
|
|
Миксотрофное питание как пример экологически приемлемой технологии для культивирования цианобактерии Arthrospira (Spirulina) platensis (Nordst) Geitler
Горбунова С.Ю., Жондарева Я.Д. Svetlana Yu. Gorbunova, Yana D. Zhondareva
Институт морских биологических исследований имени А.О. Ковалевского (г. Севастополь)
УДК 582.232:581.13
Исследован рост цианобактерии Arthrospira (Spirulina) platensis на питательной среде, приготовленной на вытяжке из кроличьего навоза в условияхискусственного освещения. Экспериментально показано, что с каждым последующим удвоением времени сбраживания органического удобрения максимальная плотность спирулины увеличивается примерно в 1,2 раза. Выявлено, что оптимальным периодом сбраживания является результат в варианте эксперимента с 21-дневной вытяжкой из кроличьего навоза. При этом максимальная продуктивность и плотность культуры Arthrospira platensis была ниже контрольного варианта со стандартной средой Заррук лишь на 5 и 9%, соответственно. Полученные результаты по культивированию A. platensis на подобных органических средах могут послужить основой для разработки экологически приемлемой технологии выращивания низших фотоавтотрофов. Ключевые слова: цианобактерии; низшие фотоавтотрофы; Arthrospira (Spirulina) platensis; продуктивность культуры; вытяжка из кроличьего навоза; органические среды.
Введение Синезеленые водоросли являются автотрофными организмами, т.е. они могут синтезировать органические молекулы самостоятельно из неорганических веществ. Стехиометрическая формула для наиболее распространенных элементов в водорослевой клетке – C106H181O45N16P, и они должны присутствовать в этих пропорциях в среде для оптимального роста клеток (Oswald, 1988). Все растительные организмы ассимилируют неорганический углерод в процессе фотосинтеза. Солнечная энергия преобразуется в химическую энергию с кислородом в качестве побочного продукта, на втором этапе химическая энергия используется, чтобы поглощать углекислый газ и преобразовывать его в сахара (Wood, 1999; Ogbonna, 2000). Кроме того, некоторые виды водорослей способны поглощать органические источники углерода и использовать их при дыхании в качестве источника энергии. Как правило, для увеличения скорости роста и плотности культуры оксигенных фототрофов при миксотрофном и гетеротрофном способе питания используют среды, в которых в качестве органического источника углерода чаще всего выступают глюкоза, ацетат или глицерин (Combres, 1994; Garcia, 2006). Результаты собственных исследований показали, что скорость роста зеленых микроводорослей Tetraselmis viridis и диатомовых микроводорослей Phaeodactylum tricornutum соответственно в 1,5 и 1,7 раз выше при использовании глицерина в качестве источника углерода и энергии, чем при фотоавтотрофном режиме культивирования (Жондарева, Тренкеншу, 2016; Жондарева, 2016). Кроме углерода еще одним важным питательным веществом для оптимального роста микроводорослей является азот, поскольку он составляет более 10% биомассы (Becker, 1994). Также существенным элементом для роста водорослей является фосфор, который поглощается ими как неорганический ортофосфат. Фосфор используется клеткой главным образом для производства фосфолипидов, АТФ и нуклеиновых кислот. В качестве питательных сред для культивирования низших фотоавтотрофов, богатых всеми вышеперечисленными биоорганическими соединениями, могут использоваться сточные воды сельскохозяйственных предприятий (Горбунова, 2013; Лукьянов, 2013; Горбунова, 2015). Как правило, на подобных органических средах культивируют те штаммы, которые способны к миксотрофному росту, поскольку в этом случае возможна параллельная утилизация неорганического и органического углерода. Также они должны иметь высокие скорости роста и накопления биомассы, чтобы уменьшить риск микробной контаминации сред (Muñoz, 2006; Sivakumar, 2012). Одними из наиболее продуктивных считаются цианобактерии рода Arthrospira, обитающие преимущественно в естественных пресных водоемах, однако способные к развитию и в морской воде. Кроме того, они давно известны и представляют интерес как биотехнологически ценный объект, что, безусловно, является существенным преимуществом для их применения в промышленности (Belay, 2002; Eriksen, 2008; Vonshak, 1997). Принимая во внимание нарастающую в настоящее время проблему сброса стоков в водоемы без соблюдения регламента очистки и контроля (Афанасьев, 2012; НТП 17-99, 2001), что приводит к эвтрофикации и заражению вод патогенной микрофлорой, актуальным становится поиск эффективных и экологически безопасных способов утилизации отходов животноводства. В связи с этим были определены цели работы: исследовать возможность выращивания цианобактерии Arthrospira platensis на сточных водах кролеферм и дать рекомендации по приготовлению органической вытяжки из кроличьего помета как источника углерода, энергии и питательного субстрата при культивировании водорослей.
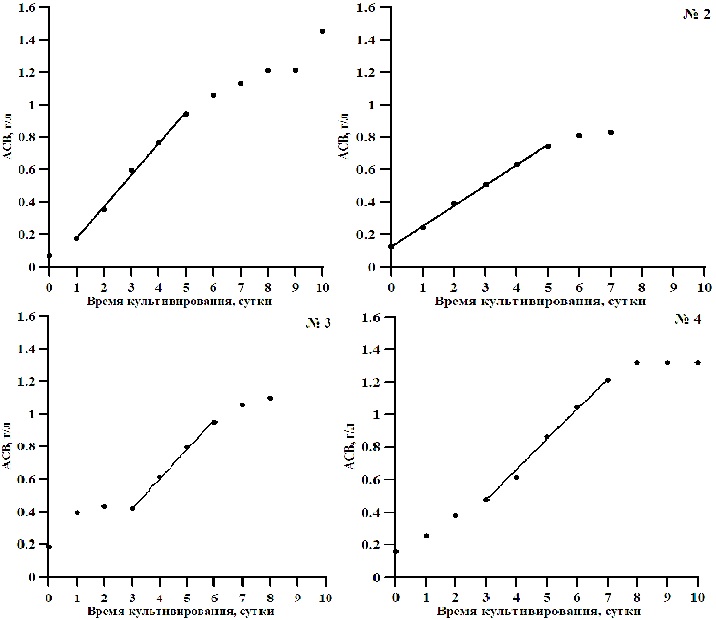
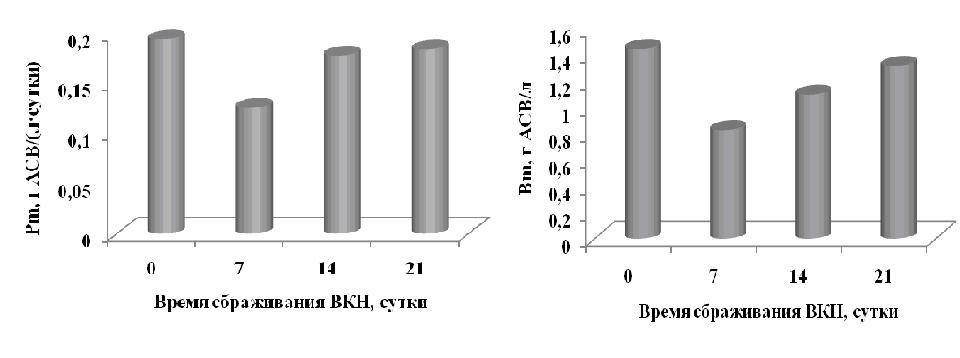
Материалы и методы Экспериментальная работа выполнена на базе отдела Биотехнологии и фиторесурсов ФГБУН ИМБИ РАН имени А.О. Ковалевского. В качестве объекта исследования выбран штамм альгологически чистой культуры цианобактерии Arthrospira platensis (Nordst.) Geitler. Культуру выращивали на унифицированной установке в стеклянных фотобиореакторах плоскопараллельного типа объёмом 3 литра, размерами 40×20×5 см с глубиной освещаемого слоя 5 см при круглосуточном освещении (Тренкеншу, 2017). Эксперимент проводили в 4-х вариантах (далее №1 – контроль, №2, №3 и №4). В контрольном варианте опыта при культивировании спирулины использовали стандартную минеральную питательную среду Заррук (Zarrouk, 1966). В качестве источника биогенных элементов использовали вытяжку из кроличьего навоза (ВКН), содержащую все основные элементы питания для микроводорослей. Для этого кроличий навоз разводили водой в соотношении 1:9 и сбраживали в закрытой емкости. Отличие вариантов заключалось в продолжительности сбраживания навоза. Таким образом, вариант №2 соответствует 7-дневному, №3 – 14-дневному, №4 – 21-дневному сбраживанию кроличьего навоза. Для осаждения взвеси и снижения мутности полученный раствор центрифугировали и фильтровали. Соотношение питательных веществ в кроличьем навозе зависит от условий кормления и содержания кроликов, в среднем при влажности, определенной авторами Li-li B. и др. (2013) как 65%, 1 тонна кроличьего навоза содержит 108,5 кг сульфата аммония, 100,9 кг суперфосфата и 17,85 кг серной кислоты и калия (Anon, 1998)). Рядом исследователей продемонстрированы некоторые физические и химические свойства различных компостных материалов, в том числе и кроличьего навоза (таблица 1) (Li-li, 2013).
Таблица 1. Физические и химические свойства кроличьего навоза Table 1. Physical and chemical properties of rabbit manure
Экспериментальным путем была установлена влажность используемого помета кроликов, которая составила 69,54%, что сопоставимо с литературными данными (Попов, 1990; Li-li, 2013). Для равномерного распределения питательных веществ между клетками культура непрерывно барботировалась. Температуру суспензии поддерживали в диапазоне 29–32°С. Прирост клеток определяли по изменению оптической плотности суспензии на фотоэлектроколориметре КФК-2 в области длины волны 750 нм (D750). Измерения проводили в стеклянных кюветах с длиной рабочей стороны 0,5 см. Погрешность измерения не превышала 1,0%. В качестве контроля использовали супернатант, соответствующий каждому из вариантов эксперимента. Для этого пробы каждого культиватора центрифугировали в течение 15 мин на лабораторной центрифуге ОПН-3 с максимальным фактором разделения g=1,870 при 3000 об/мин. Плотность культуры (сухой вес) вычисляли, используя коэффициент перехода от оптической плотности (Боровков, 2005):
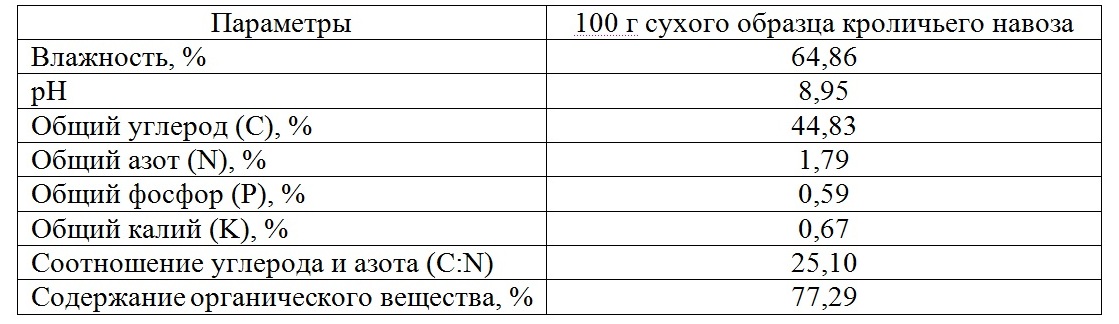
Результаты и обсуждение Микроводоросли культивировали непрерывным способом в накопительном режиме (Тренкеншу, 2005) (рис. 1). Во всех вариантах эксперимента рост микроводорослей имел типичную S-образную форму. Аппроксимированием линейной фазы накопительной кривой роста определяли максимальную продуктивность (Pm) культуры микроводорослей (Тренкеншу, 1984):
где B – биомасса, г·сут-1; t – время, сут.; B0 – биомасса в начале линейной фазы роста.
Рис.1. Динамика плотности накопительной культуры Arthrospira platensis Fig.1. The dynamics of the cumulative growth of Arthrospira platensis on Zarrouk standard medium
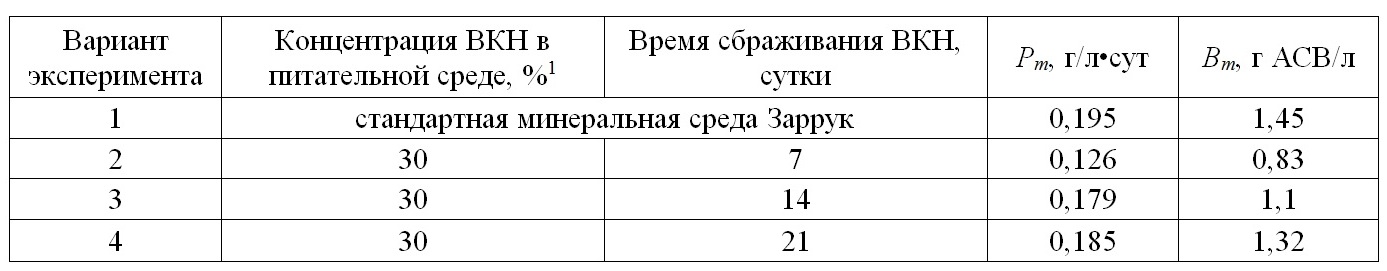
С увеличением времени сбраживания ВКН максимальная продуктивность (Pm) и максимальная биомасса культуры (Bm) A. platensis повышаются (таблица 2, рис. 2).
Таблица 2. Параметры роста накопительной культуры Arthrospira platensis на стандартной среде Заррук и органической питательной среде Table 2. The parameters of the cumulative growth Arthrospira platensis on Zarrouk standard medium
Примечания. ВКН – вытяжка из кроличьего навоза; Pm – максимальная продуктивность культуры A. platensis, г/л • сут; Bm – максимальная плотность культуры A. platensis, г АСВ/л.
Рис. 2. Зависимость максимальной продуктивности и максимальной биомассы A. platensis Fig. 2. The dependence of maximum productivity and maximum biomass of A. platensis
С каждым последующим удвоением времени сбраживания органического удобрения максимальная плотность спирулины увеличивалась примерно в 1,2 раза. Оптимальным оказался результат в варианте эксперимента № 4 с 21-дневной вытяжкой из кроличьего навоза. Здесь максимальная продуктивность и плотность Arthrospira platensis была ниже контрольного варианта со стандартной средой Заррук лишь на 5 и 9%, соответственно. Свежий кроличий навоз в своем составе имеет высокое содержание мочевины. Ранее экспериментально было показано, что высокие концентрации карбамида в питательной среде угнетают рост водорослей и других низших фотоавтотрофных организмов вплоть до гибели клеток (Дробецкая, 2002). В связи с этим можно предположить, что с увеличением времени сбраживания навоза большая часть азота мочевины улетучивается, и создаются оптимальные условия для роста A. platensis. Таким образом, органическая вытяжка из навоза кроликов может служить богатым источником питательных веществ и широко использоваться в практике массового культивирования A. platensis. Учитывая, что затраты на приготовление питательных сред составляют около 40% от себестоимости 1 кг микроводорослей, использование сельскохозяйственных сточных вод в качестве органических питательных сред позволит значительно снизить себестоимость биомассы спирулины, а также утилизировать отходы с/х животных (Горбунова, 2013). Полученный урожай микроводорослей можно использовать в качестве полноценной биологически активной добавки в рационе сельскохозяйственных животных. Так, ранее проведенные исследования показали, что введение в рацион животных суспензии микроводорослей в дозе 0,1 г/кг живого веса в течение 30 дней способствует увеличению живой массы по сравнению с контрольной группой на 28%. Результаты проведенных исследований многократно подтверждены и имеют высокую практическую значимость для сельского хозяйства (Лукьянов, 2013). Кроме того, биомасса микроводорослей, выращенная на средах, содержащих органические вытяжки из отходов агропромышленных комплексов, эффективно используется для альголизации почв и способствует увеличению урожая с/х культур (Доброжан, 2012; Лукьянов, 2013; Stifeev, 2013).
Заключение В результате обзора литературных источников и собственных экспериментов показано, что органическая вытяжка из кроличьего навоза может служить богатым источником питательных и ростостимулирующих веществ и широко использоваться в практике массового культивирования микроводорослей, что позволит снизить себестоимость биомассы Arthrospira platensis. Экспериментально установлено, что для повышения максимальной продуктивности А. platensis необходимо увеличивать время сбраживания кроличьего навоза, оптимальным является период в 21 сутки. Таким образом, кроличий навоз может быть преобразован в источник ценного удобрения. Такой подход к культивированию низших фототрофов является весьма перспективным, поскольку позволяет объединить технологии утилизации помета с/х производств, биологической очистки их сточных вод и накопления биомассы микроводорослей. При этом собственно биомасса микроводорослей может быть использована в качестве ценной кормовой добавкой биологической природы для сельскохозяйственных животных, а также в практике альголизации почв.
Работа выполнена по теме Госзадания ФГБУН ИМБИ № 1001-2014-0017.
Список литературы 1. Афанасьев А.В. Анализ технологий переработки навоза и помета // Вестник ВНИИМЖ. 2012. Т.4. С. 28–35. 2. Боровков А.Б., Геворгиз Р.Г. Продуктивность Spirulina platensis и Tetraselmis viridis при использовании различных методов культивирования // Экология моря. 2005. Вып.70. С. 9–13. 3. Горбунова С.Ю. Культивирование Spirulina platensis (Nordst.) Geitler на минерально-органической питательной среде // Бюллетень Никитского ботанического сада. 2013. Вып. 109. С. 8–13. 4. Горбунова С.Ю., Жондарева Я.Д. Использование сточных вод птицефабрик для увеличения продуктивности Arthrospira platensis (Nordst.) Geitler // Вестник СПбГУ. Сер. 3. 2015. №1. С. 70–77. 5. Жондарева Я.Д., Тренкеншу Р.П. Фотоавтотрофный и миксотрофный рост Tetraselmis viridis в накопительной культуре // Актуальные вопросы биологической физики и химии. – Севастополь, 2016. – Т.2. – С. 106–109. 6. Доброжан С.Н., Семенюк Е.Н. Использование водоросли Spirulina platensis (Gomont) Geitler, выращенной на сточных водах, в качестве растительного биостимулятора // Актуальные проблемы современной альгологии: Тезисы докладов IV Международной конференции. – Киев, 2012. – С. 99–100. 7. Дробецкая И.В. Использование мочевины при выращивании синезеленой микроводоросли Spirulina platensis (Nords.) Geitl. в накопительной культуре // Экология моря. 2002. Т.65. С. 53–59. 8. Жондарева Я.Д. Миксотрофный рост Phaeodactylum tricornutum на неорганической среде с глюкозой и глицерином в накопительной культуре // Морские биологические исследования: достижения и перспективы: сборник материалов Всероссийской научно-практической конференции с международным участием, приуроченной к 145-летию Севастопольской биологической станции. – Севастополь: ЭКОСИ–Гидрофизика, 2016. – Т.3. – С. 378–382. 9. Лукьянов В.А., Горбунова С.Ю. Микроводоросль Chlorella vulgaris в утилизации сточных вод птицефабрик // Молодежь и инновации – 2013: сборник материалов Международной научно-практической конференции молодых ученых. В 4-х ч. / Гл. ред. А.П. Курдеко. – Горки: Белорусская государственная сельскохозяйственная академия, 2013. – Ч.2. – С. 159–162. 10. Лукьянов В.А., Стифеев А.И., Горбунова С.Ю. Почвам – микроводоросли, человеку – здоровое питание // 17-ая Международная Пущинская школа–конференция Молодых ученых «Биология – наука XXI века», 22–26 апреля 2013 г.: тезисы докл. – Пущино, 2013. – С. 303. 11. Лукьянов В.А., Горбунова С.Ю. Экотехнологичекая система утилизации отходов агропромышленного комплекса и получение на их основе биомассы микроводорослей // Актуальные проблемы гуманитарных и естественных наук. 2014. №6-1. С. 79–82. 12. НТП 17-99: Нормы технологического проектирования систем удаления и подготовки к использованию навоза и помета. – М.: Министерство сельского хозяйства Российской Федерации, 2001. – 84 с. 13. Попов А.В. Применение удобрений на приусадебном участке. – Л: Агропромиздат, 1990. – 65 с. 14. Тренкеншу Р.П. Ростовые и фотоэнергетические характеристики морских микроводорослей в плотной культуре: Автореф. дисс. канд. биол. наук. – Красноярск, 1984. – 28 с. 15. Тренкеншу Р.П. Простейшие модели роста микроводорослей. 1. Периодическая культура // Экология моря. 2005. Вып. 67. С. 89–97. 17. Approximate N, P and K values of nutrient content of four successive crop of various animal manure // Countryside & small stock J. 1998. V.7. P. 9–10. 18. Becker E.W. Microalgae, Biotechnology and Microbiology / Cambridge: Cambridge University Press, 1994. – 304 p. 19. Belay A. The potential application of Spirulina (Arthrospira) as a nutritional and therapeutic supplement in health management // J. Amer. Nutr. Ass. 2002. V.5, №2. P. 27–47. 20. Combres C., Laliberté G., Reyssac J.S., Noüe J. Effect of acetate on growth and ammonium uptake in the microalga Scenedesmus obliquus // Physiol. Plantarum. 1994. V.91, №4. P. 729–734. 21. Eriksen N. Production of phycocyanin-a pigment with applications in biology, biotechnology and medicine // Appl. microbiol. and biotechnol. 2008. V.1. P. 1–14. 22. Muñoz R., Guieysse B. Algal-bacterial processes for the treatment of hazardous contaminants: a review // Water Res. 2006. V.40. P. 2799–2815. 23. García M.C., Camacho F.G, Miron A.S., Sevilla J.M.F., Chisti Y., Grima E.M. Mixotrophic production of marine microalga Phaeodactylum tricornutum on various carbon sources // J. Microbiol. Biotechnol. 2006. V.16, №5. P. 689–694. 24. Sivakumar G., Xu J., Thompson R.W., Yang Y., Randol-Smith P., Weathers P.J. Weathers Integrated green algal technology for bioremediation and biofuel / G. Sivakumar, // Biores. Technol. 2012. V.107 P. 1–9. 25. Li-li B., Tie-jun Y., Bin W., Lin B., De-gui T., Xiang-chao F. Evaluation and comparison of composting rabbit manure mixed with mushroom residue and rice straw // J. of Agricultural Science and Technology. 2013. V.15. P. 1069–1081. 26. Ogbonna J.C., Yoshizawa H., Tanaka H. Treatment of high strength organic wastewater by a mixed culture of photosynthetic microorganisms // J. Appl. Phycol. 2000. V.12. P. 277–284. 27. Oswald W.J. Microalgae and waste-water treatment in Microalgal biotechnology // Borowitzka M.A., Borowitzka L.J. (Eds.). Micro-algal Biotechnology. – Cambridge: Cambridge University Press, 1988. – P. 305–328. 28. Stifeev A.I., Bessonova E.A., Lukyanov V.A. Microalgae as innovative object in organic agriculture // Vestnik OrelGAU. 2013. T.43, №4. С. 26-27. 29. Vonshak A. Spirulina platensis (Arthrospira): Physiology, Cell-biology and Biotechnology. – London: Taylor & Francis, 1997. – P. 43–65. 30. Wood B.J.B., Grimson P.H.K., German J.B., Turner M. Photoheterotrophy in the production of phytoplankton organisms // J. Biotechnol. 1999. V.70. № 1–3. P. 175–183. 31. Zarrouk C. Contribution a l’etude d’une cyanophycee. Influence de divers facteurs physiques et chimiques sur la crossance et la photosynthese de Spirulina maxima: Doctorate thesis.. – Paris: University of Paris, 1966. – 83 p. Статья поступила в редакцию 18.08.2017, после доработки – 25.09.2017
Mixotrophic food as an example of environmentally friendly technology for the cultivation of cyanobacteria Arthrospira (Spirulina) platensis (Nordst) Geitler Svetlana Yu. Gorbunova, Yana D. Zhondareva A.O. Kovalevsky Institute of Marine Biological Research of RAS (Sevastopol, Russia) The growth of cyanobacteria Arthrospira (Spirulina) platensis was investigated on the nutrient medium preparing on the extract of rabbit manure under artificial lighting. It was experimentally shown; each successive doubling time of organic fertilizers enhances maximum density of A. platensis about 1.2 times. It was found, the result of the experiment in the variant with a 21-day fermentation of rabbit manure was the best. Maximum productivity density of culture Arthrospira platensis was lower only on 5 and 9%, respectively, compared with standard medium Zarrouk. The results obtained in the cultivation A. platensis on such organic media can serve as a basis for the development of environmentally acceptable technologies of cultivation of the lower photoautotrophs. Keywords: cyanobacteria; lower photoautotrophs; Arthrospira (Spirulina) platensis; productivity of culture; an extract of rabbit manure; organic media.
Об авторах Горбунова Светлана Юрьевна - Gorbunova Svetlana Yu. кандидат биологических наук svetlana_8423@mail.ru Жондарева Яна Дмитриевна – Zhondareva Yana D. младший научный сотрудник, Институт морских биологических исследований им. А.О.Ковалевского РАН (ФГБУН ИМБИ), г. Севастополь, Россия (Federal State Institution of Science «The A. O. Kovalevsky Institute of Marine Biological Research of RAS» IMBR, Sevastopol, Russia), Отдел биотехнологий и фиторесурсов. yana.zhondareva@yandex.ru Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФГБУН ИМБИ; тел. (8692)-54-41-10.
ССЫЛКА НА СТАТЬЮ: Горбунова С.Ю., Жондарева Я.Д. Миксотрофное питание как пример экологически приемлемой технологии для культивирования цианобактерии Arthrospira (Spirulina) platensis (Nordst) Geitler // Вопросы современной альгологии.2017. № 2 (14). URL: http://algology.ru/1176 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ

|
|||
|
| ||