|
|
|
|
V Сабининские чтения 29 ноября 2016 - 29 января 2017 Апробация двухстадийного выращивания Dunaliella salina Teod. в полупромышленных условиях
Боровков А.Б., Гудвилович И.Н. Andrey B. Borovkov, Irina N. Gudvilovich
Институт морских биологических исследований имени А.О. Ковалевского (г. Севастополь)
УДК 582.232:[581.143+577.122.5]
Проведена апробация двухстадийного культивирования Dunaliella salina в полупромышленных условиях с использованием полупроточного метода выращивания. Показана возможность использования её природной популяции в качестве инокулята; осуществлён перевод дуналиеллы из «красной формы» в «зелёную», активно растущую. Показано, что повышение освещённости и солёности среды на фоне дефицита биогенных элементов вызывает переход D. salina на стадию каротиногенеза с повышением относительного содержания каротиноидов в 9 раз. Ключевые слова: Dunaliella salina; двухстадийное культивирование; полупроточная культура; каротиноиды
Известно, что производительность закрытых фотобиореакторов или лабораторных установок значительно выше, чем открытых систем выращивания микроводорослей (в 2 и более раз) (Боровков, Гудвилович, 2015 a,b; García-González, et al., 2003; Lee, 2001). В качестве факторов, оказывающих такое значительное влияние на снижение продуктивности культур, обычно указывают нестабильные физико-химические условия среды и так называемый «эффект масштабирования», когда при переходе от лабораторных к промышленным установкам при соблюдении одинаковых условий (питательная среда, температура, pH, скорость перемешивания, тип аппарата) скорость роста культуры и скорость синтеза целевого продукта могут существенно отличаться). Это обуславливает необходимость промежуточного этапа при переходе от лабораторных систем культивирования к промышленным, когда выращивание микроводорослей осуществляется в условиях и установках аналогичных промышленным, но на небольших площадях. Рост культур в таких полупромышленных модулях, оценка химического состава получаемой биомассы микроводорослей и производительности систем позволяет корректировать технологическую схему и избежать значительных ошибок при внедрении технологии выращивания в промышленных масштабах. Зелёная микроводоросль Dunaliella salina Teod. широко известна как один из наиболее перспективных природных источников β-каротина. Ещё в 60-х годах 20 в. Н.П.Масюк был предложен двухэтапный метод культивирования D. salina в открытых бассейнах, предусматривающий на первом этапе создание условий, способствующих накоплению биомассы микроводоросли, а на втором – инициирующих накопление β-каротина в её клетках (Масюк, 1973). Использующиеся в настоящее время промышленные технологии выращивания D. salina также предусматривают, как правило, двухстадийный способ культивирования водоросли (Ben-Amotz, 1995; Lee, 2001), в основе которого лежит метод периодических культур. Представляется актуальным ввести в технологическую схему промышленного выращивания D. salina менее распространённый полупроточный (квазинепрерывный) способ культивирования, обеспечивающий стабильную продуктивность культуры, что экспериментально подтверждено лабораторными исследованиями (Гудвилович, Боровков, 2012; Гудвилович и др., 2015). Цель работы – апробация двухстадийного культивирования D. salina в полупромышленных условиях с использованием полупроточного метода выращивания.
Материалы и методы Работы выполняли на базе тепличного комплекса (ООО«Меркурий-II», г. Харьков) и на базе Крымских солепромыслов (ПК «Галит», г. Саки). Культуру микроводоросли D. salina выращивали на модифицированной питательной среде, разработанной Shaish с соавт. (Shaish et al., 1990). Модификация заключалась в добавлении морской соли до концентрации в растворе 120 г·дм-3. Культиваторами служили прямоугольные бассейны 2×1 м из полиэтиленовой пленки, уложенной на выровненную поверхность грунта. Объем культуры в каждом культиваторе составлял 200 л, при высоте слоя раствора 10 см. Этот объем на протяжении всего эксперимента поддерживали постоянным, доливая пресную воду перед измерениями до отметки 10 см. Водоросли выращивали при естественном освещении и непрерывном перемешивании с помощью аквариумной помпы «Atman». В процессе выращивания поддерживали оптимальную рН среды (7-8). На базе ООО «Меркурий-II» культуру D. salina (штамм IMBR-2 из коллекции культур ФГБУН ИМБИ РАН) первоначально выращивали в полупроточном (квазинепрерывном) режиме 5 суток, с ежесуточным обменом 10%. На втором этапе, продолжавшемся 7 суток, использовали накопительный режим культивирования. Выросшую на первом этапе культуру дуналиеллы отбирали из бассейна и разбавляли в 5 и 10 раз. На базе ПК «Галит» оранжевые клетки D. salina, отобранные из солесадочных бассейнов, помещали в экспериментальные бассейны с питательной средой. На втором этапе выросшую культуру микроводоросли отбирали из бассейна и разбавляли в 2 раза. В обоих случаях разбавление проводили питательной средой без солей – источников азота и фосфора – и постепенно, в течение суток, повышали солёность в бассейнах от 120 до 240 г/л. В процессе выращивания в культуру дополнительно подавали СО2 (ПК «Галит», г. Саки). Содержание сухого вещества в культуре (СВ) определяли объемно-весовым (Тренкеншу, 1984), а также фотометрическим методами (Методы…, 1975). Количественное определение содержания пигментов проводили спектрофотометрическим методом (Методы…, 1975). Хлорофиллы и каротиноиды экстрагировали из клеток 100% ацетоном. Спектры экстрактов пигментов регистрировали на спектрофотометре СФ-2000 в диапазоне длин волн 400-800 нм с шагом 0,1 нм. Расчет концентраций пигментов проводили по формулам, предложенным A.R.Wellburn (1994), по значениям оптической плотности на длинах волн, соответствующих максимумам поглощения соответствующих пигментов. Определяемые показатели химического состава выражали в пересчете на органическое вещество (ОВ). Массовую долю зольного остатка в сырой биомассе микроводорослей определяли путем предварительного высушивания навесок при 105°С в течение 24 ч и последующего сжигания в муфельной печи при t = 500°С до постоянного веса (Методы…, 1975).
Результаты и их обсуждение Ранее в лабораторных экспериментах показано, что квазинепрерывный способ выращивания D. salina может обеспечить стабильную продуктивность культуры 0,46 г ОВ с 1 л культуры в сутки, при содержании каротиноидов до 1% ОВ. Показано, что культивирование дуналиеллы в две стадии накопительным способом имеет ряд преимуществ (по накоплению и выходу β-каротина) по сравнению с одностадийным (квазинепрерывным) методом. Так, комбинация факторов повышенной освещенности и солёности при дефиците минерального субстрата в среде вызывает накопление содержания β-каротина в клетках D. salina до 8% ОВ, продуктивность культуры по β-каротину при этом увеличивается в 2,7 раза по сравнению с квазинепрерывным выращиванием данного вида в сопоставимых условиях (Боровков, Гудвилович, 2015; Гудвилович, Боровков, 2012). На следующем этапе проводили оценку производительности полупромышленного модуля, аналогичного горизонтальным культиваторам на производстве, однако выращивание дуналиеллы вели в лабораторных условиях. Используемые в опыте концентрированные питательные среды рассчитаны на получение 4–5 г биомассы с 1 л культуры в пересчёте на сухое вещество (СВ) (Гудвилович и др., 2015). При заданной скорости протока среды (0,03–0,05 сут-1) в экспериментальные культиваторы при обмене поступало 1,5–3 г азота, что позволяет получать 8–11 г СВ биомассы с 1 м2 культиватора в сутки даже при нижнем пороге поступления азота в среду.
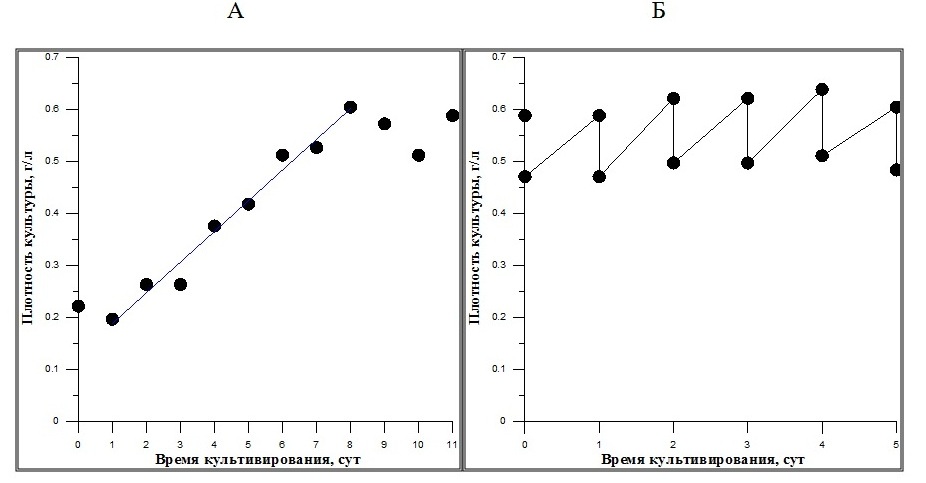
Рис. 1. Общий вид полупромышленного модуля для культивирования D. salina Реальная средняя продуктивность для D. salina в таких условиях в эксперименте была ниже расчётной и составляла 6 г СВ с 1 м2 в сутки, что, по-видимому, определялось поверхностной освещённостью культиватора, увеличившейся толщиной слоя культуры и сменой типа культиватора. Содержание каротиноидов и хлорофилла а в выращенной биомассе D. salina соответствовало норме для «зелёной», активно растущей культуры. При переходе к промышленному выращиванию микроводорослей тип культиваторов остаётся таким же, однако значительно меняются световые и температурные условия по сравнению с лабораторией. Эти факторы приводят к значительным потерям урожая биомассы. Поэтому промышленное выращивание микроводорослей желательно организовывать на базе специальных тепличных хозяйств, в которых культивирование осуществляется в бетонированных или плёночных бассейнах, что в какой-то мере способствует стабилизации температуры в бассейнах и ограничивает контакт культур и питательных сред с окружающей средой. На рис. 2 представлены графики роста культуры D. salina при её выращивании в бассейнах на базе тепличного комплекса (ООО «Меркурий», г. Харьков). На первом этапе предварительно повысили рабочую плотность культуры дуналиеллы в 3,5 раза; её средняя продуктивность при этом составила 0,06 г СВ с 1 л культуры в сутки (рис. 2 А).
Рис. 2. Плотность культуры D. salina при её выращивании на базе тепличного комплекса (ООО «Меркурий», г. Харьков): Fig. 2. Density of D. salina culture, grown in greenhouse complex («Mercuriy» Ltd, Kharkov):
После этого культуру перевели в квазинепрерывный режим со средней удельной скоростью протока 0,1 сут-1. При таком режиме выращивания плотность культуры значительно не изменялась и находилась в пределах 0,59–0,68 г СВ/л, то есть культура фактически находилась в состоянии стационарного динамического равновесия (рис. 2 Б). Продуктивность культуры D. salina по биомассе при выращивании в квазинепрерывном режиме составила 6 г∙м-2∙сут-1, это в 3 раза выше, чем на производствах в Израиле и Испании (Ben-Amotz, 1995, García-González, 2003). Следует отметить, что полученная продуктивность для региона восточной Украины достигнута без использования добавок углекислого газа в культуральную среду. На этой стадии роста культуры для двух представленных режимов выращивания содержание пигментов варьировало в пределах 1,7–2,1 и 0,6–0,8% ОВ для хлорофилла а и каротиноидов, соответственно, то есть находилось в пределах, характерных для активно растущей «зелёной формы» D. salina (рис. 3). По литературным и собственным данным, основным стрессовым фактором для индукции синтеза β-каротина является совместное воздействие (комбинация) высокой освещённости и дефицита биогенных элементов (Масюк, 1973, Боровков, Гудвилович, 2015 a,b; Ben-Amotz et al., 1989; Ben-Amotz, 1995; Lamers, 2010). Однако, на втором этапе после повышения освещённости в 5 и 10 раз (за счёт разбавления культуры) и повышения солёности среды в 2 раза не произошло индукции синтеза β-каротина. В последующие 6 суток относительное содержание хлорофилла а в клетках водоросли в двух вариантах эксперимента в среднем составляло 0,6–0,7% ОВ. Содержание каротиноидов при разбавлении культуры D. salina в 5 раз изменялось незначительно (0,2–0,3% ОВ), а при десятикратном разбавлении – постепенно увеличивалось (с 0,15 до 0,45% ОВ).
Рис. 3. Общий вид полупромышленного модуля для культивирования D. salina на базе тепличного комплекса (ООО «Меркурий», г. Харьков) Fig. 3. General view on semi-industrial module for D. salina cultivation in greenhouse complex («Mercuriy» Ltd, Kharkov)
По-видимому, отрицательную роль сыграли погодные условия: пасмурная погода на протяжении всего эксперимента не позволила достигнуть уровня необходимой освещённости для индукции синтеза каротиноидов. Однако для варианта с 10-кратным разбавлением наблюдалось повышение соотношения Кар/Хл а (от 0,3 до 0,65), что свидетельствует о перестройке пигментного аппарата и предшествует активному накоплению каротиноидов в клетках дуналиеллы. Дальнейшие исследования по подбору условий и оптимизации перевода культуры D. salina от стадии активного роста к накоплению каротиноидов были продолжены на базе Крымских солепромыслов (ПК «Галит», г. Саки). В солесадочных бассейнах в летний период при постепенно повышающейся солёности D. salina развивается практически в монокультуре, вызывая так называемое «красное цветение», что делает особенно актуальным исследования по возможности введения интенсивной культуры дуналиеллы в технологическую схему работы солепромыслов. Для проведения эксперимента было решено использовать природную популяцию D. salina, клетки которой наиболее адаптированы к экстремальным климатическим условиям западной части Крымского полуострова. Первоначально оранжевые клетки D. salina были перемещены из солесадочных бассейнов в экспериментальные культиваторы с питательной средой (рис. 4).
Рис. 4. Вид экспериментальных бассейнов с оранжевыми клетками D. salina, отобранными из солесадочных бассейнов (ПК «Галит»). Fig. 4. Overview of experimental pools with D. salina orange cells, selected from the saline reservoirs (IC «Galit»)
Солёность в экспериментальных бассейнах была постепенно снижена до оптимальных значений, таким образом, были созданы оптимальные условия для активного роста клеток дуналиеллы (Масюк, 1973; Ben-Amotz, 1995). На протяжении 1,5 недель происходила постепенная адаптация клеток D. salina к изменившимся условиям, сопровождавшаяся их частичной гибелью; цвет живых клеток постепенно менялся от оранжевого к зелёному (рис. 5).
Рис. 5. Вид экспериментальных бассейнов с культурой D. salina на стадии активного роста
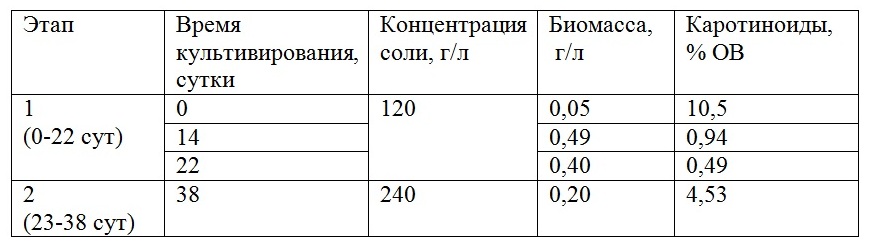
После добавления свежей питательной среды наблюдался значительный рост численности клеток микроводоросли. В результате плотность культуры D. salina за 2 недели выращивания увеличилась в 10 раз (табл. 1).
Таблица 1. Содержание каротиноидов и плотность культуры D. salina при её выращивании на базе солепромыслов (ПК «Галит», г. Саки) Table 1. Carotenoids content and D. salina culture density when being grown on salt mine base (IC «Galit», Saki)
Смена морфологических форм клеток от оранжевых к зеленым сопровождалась изменением количественного состава пигментов. Так, содержание каротиноидов снизилось в 20 раз (до 0,5% ОВ) за 3 недели культивирования, а хлорофилла а, напротив, увеличилось от 0,3 до 0,85% ОВ (см. Табл. 1). После исчерпания в среде элементов минерального питания рост культуры остановился. При проведении этого эксперимента мы также выбрали в качестве воздействующих факторов для индукции каротиногенеза повышение освещённости (за счёт разбавления культуры в 2 раза) и повышение солёности среды от 120 до 240 г/л. В результате на втором этапе содержание каротиноидов в клетках D. salina увеличилось в 9 раз (до 4,5 % ОВ) (рис. 6), а содержание каротиноидов в бассейнах достигало 75 мг/м2. Смена морфологических форм клеток от оранжевых к зеленым сопровождалась изменением количественного состава пигментов. Так, содержание каротиноидов снизилось в 20 раз (до 0,5% ОВ) за 3 недели культивирования, а хлорофилла а, напротив, увеличилось от 0,3 до 0,85% ОВ (см. Табл. 1). После исчерпания в среде элементов минерального питания рост культуры остановился. При проведении этого эксперимента мы также выбрали в качестве воздействующих факторов для индукции каротиногенеза повышение освещённости (за счёт разбавления культуры в 2 раза) и повышение солёности среды от 120 до 240 г/л. В результате на втором этапе содержание каротиноидов в клетках D. salina увеличилось в 9 раз (до 4,5 % ОВ) (рис. 6), а содержание каротиноидов в бассейнах достигало 75 мг/м2.
Рис. 6. Вид экспериментальных бассейнов с культурой D. salina на стадии каротиногенеза Fig. 6. Overview of experimental pools with D. salina culture at the stage of carotenogenesis (IC «Galit»)
Таким образом, возможно промышленное получение в интенсивной культуре биомассы D. salina в тепличных хозяйствах на базе солепромыслов. В качестве основы для приготовления питательной среды рекомендуется использовать рапу из солесадочных бассейнов, содержащую макро- и микроэлементы, а в качестве инокулята – клетки D. salina естественной популяции. При этом, при такой организации не исключается промышленная добыча морской соли на солепромыслах, в том числе и обогащенной β-каротином. Кроме того, данный способ не требует значительных материальных затрат для выращивания биомассы D. salina.
Заключение Проведена апробация двухстадийной системы промышленного культивирования D. salina с использованием квазинепрерывного метода на первом этапе выращивания, продуктивность на этом этапе составила 6 г∙м-2∙сут-1. Экспериментально показано, что на втором этапе выращивания D. salina в условиях естественного освещения в Харьковской области при пасмурной погоде повышения освещённости за счёт разбавления культуры в 5–10 раз и повышения солености культуральной среды в 2 раза оказалось недостаточно для интенсивного накопления каротиноидов, их содержание не превышало 0,5% ОВ. По-видимому, отрицательную роль сыграли погодные условия, так как при аналогичном проведении эксперимента по выращиванию D. salina на базе Сакских солепромыслов в условиях преимущественно ясной солнечной погоды, содержание каротиноидов увеличилось в 9 раз (от 0,5 до 4,5% ОВ). Показана возможность использования природной популяции D. salina солесадочных бассейнов в качестве инокулята при её полупромышленном выращивании. Успешно осуществлён перевод дуналиеллы из «красной» формы в её «зелёную», активно растущую форму. Экспериментально показано, что повышение освещённости и солёности среды на фоне дефицита биогенных элементов при промышленном культивировании D. salina в западной части Крыма вызвало её переход на стадию каротиногенеза; при этом содержание каротиноидов в культиваторах составило 75 мг/м2.
Работа выполнена в рамках темы Госзадания ФГБУН ИМБИ № 1001-2014-0017.
Список литературы 1. Боровков А.Б., Гудвилович И.Н. Интенсивное культивирование Dunaliella salina Teod. как способ получения биомассы с повышенным содержанием β-каротина. 1. Влияние факторов культивирования // Гидробиологический журнал. 2015a. Т.51, №1 (301). – С. 74–82. 2. Боровков А.Б., Гудвилович И.Н. Интенсивное культивирование Dunaliella salina Teod. как способ получения биомассы с повышенным содержанием β-каротина. 2. Оптимизация режима культивирования // Гидробиологический журнал. 2015b. Т.51, №2 (301). – С. 34–43. 3. Гудвилович И.Н., Боровков А.Б. Ростовые и биохимические показатели квазинепрерывной культуры Dunaliella salina // Біотехнологія. 2012. Т.5, №3. – С. 105–111. 4. Гудвилович И.Н., Боровков А.Б., Тренкеншу Р.П. Опыт выращивания микроводорослей-продуцентов БАВ в полупромышленных условиях // Современные технологии продуктов питания: сб. науч. статей материалы 2-й Междунар. науч.-практич. конф. (3-4 дек. 2015 года) / Горохов А.А. (отв. ред.). – Курск: Юго-Зап. гос. ун-т, ЗАО «Университетская книга», 2015. – С. 44–50. 5. Масюк Н.П. Морфология, систематика, экология, географическое распространение рода Dunaliella Teod. – Киев: Наук. думка, 1973. – 487 с. 6. Сиренко Л.А., Сакевич А.И., Осипов Л.Ф., Лукина Л.Ф., Кузьменко М.И., Козицкая В.Н., Величко И.М., Мыслович В.О., Гавриленко М.Я., Арендарчук В.В., Кирпенко Ю.А. Методы физиолого-биохимического исследования водорослей в гидробиологической практике – Киев: Наук. думка, 1975. – 247 с. 7. Тренкеншу Р.П. Ростовые и фотоэнергетические характеристики морских микроводорослей в плотной культуре: Автореф. дис. канд. биол. наук. – Красноярск, 1984. – 28 с. 8. Ben-Amotz A. New mode of Dunaliella biotechnology: two-phase growth for β -carotene production // J. of Appl. Phycol. 1995. V.7. P. 65–68. 9. Ben-Amotz A., Shaish A., Avron M. Mode of action of the massively accumulated β-carotene of Dunaliella bardawil in proteting the algae aqainst damaqe by excess irradiation // Plant. Physiol. 1989. V.91, №3. P. 1040–1043. 10. García-González M., Moreno J., Cañavate J.P., Anguis V., Prieto A., Manzano C., Florencio F.J., Guerrero M.G. Conditions for open-air outdoor culture of Dunaliella salina in southern Spain // J. Appl. Phycol. 2003. V.15. P. 177–184. 11. Lamers P.P., van de Laak C.C., Kaasenbrood P.S., Lorier J., Janssen M., De Vos R.C., Bino R.J., Wijffels R.H. Carotenoid and fatty acid metabolism in light-stressed Dunaliella salina // Biotechnol. and Bioeng. 2010. V.106, №4. P. 638–648. 12. Lee Y.K. Microalgae mass culture system and methods: Their limitation and potential // J. Appl. Phycol. 2001. V.13. P. 307–315. 13. Shaish A., Avron M., Ben-Amotz A. Effect of ingibitors on the formation of stereoisomers in the biosynthesis of β-carotene in Dunaliella bardawil // Plant. Cell. Physiol. 1990. V.31, №5. P. 689–696. 14. Wellburn A.R. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution // J. Plant Phys. 1994. V.144. P. 307–313. Статья поступила в редакцию 20.12.2016 The testing of two-stage system of semi-industrial cultivation of Dunaliella salina Teod. Аndrey B. Borovkov, Irina N. Gudvilovich The testing of two-stage system of industrial cultivation of Dunaliella salina with semicontinuous mode was carried out. The principal possibility of using D. salina’s natural population from salt reservoirs as inoculum is shown. D. salina’s transfer from «red form» to its «green form» is implemented successfully. It is experimentally shown, that the increase in salinity and illumination of environment along with nutrients shortage during industrial cultivation of D. salina causes its transition to carotenogenesis step with 9-time increase in relative content of carotenoids. Key words: Dunaliella salina; two-stage cultivation; semicontinuous culture; carotenoids
Об авторах Боровков Андрей Борисович - Borovkov Andrey B. кандидат биологических наук spirit2000@ua.fm Гудвилович Ирина Николаевна - Gudvilovich Irina N. кандидат биологических наук gudirina2008@yandex.ru Корреспондентский адрес: Россия, 299011, Севастополь, пр. Нахимова, 2, ФГБУН ИМБИ; тел. (869)-255-07-95.
ССЫЛКА НА СТАТЬЮ: Боровков А.Б., Гудвилович И.Н. Апробация двухстадийного выращивания Dunaliella salina Teod. в полупромышленных условиях // Вопросы современной альгологии. 2017. №1 (13). URL: http://algology.ru/1155 Уважаемые коллеги! Если Вы хотите получить версию статьи в формате PDF, пожалуйста, напишите в редакцию, и мы ее вам с удовольствием пришлем бесплатно.
При перепечатке ссылка на сайт обязательна
К разделу ОБЗОРЫ, СТАТЬИ И КРАТКИЕ СООБЩЕНИЯ 
|
|||
|
| ||